Multiples Myelom und MGUS
Nephrologie
Steckbrief
Eine Nierenbeteiligung bzw. Nierenerkrankung stellt eine häufige Komplikation im Rahmen eines Multiplen Myeloms oder anderer monoklonaler Gammopathien dar. Die diagnostischen Kriterien der International Myeloma Working Group (IMWG) zur Diagnose eines Multiplen Myeloms stellen die Bedeutung einer relevanten Endorganschädigung in den Vordergrund und beinhalten u.a. das Auftreten einer abnormen Nierenfunktion [7]. Im Rahmen dieser Kriterien wird häufig das Acronym CRAB (increased plasma calcium level, renal insufficiency, anemia, bone lesions) verwendet. Im Unterschied zum Multiplen Myelom muss das Krankheitsbild einer MGUS (monoclonal gammopathy of undetermined significance) differenziert werden. Die Diagnose eines MGUS beinhaltet per Definitionen das Fehlen von Endorganschäden wie z.B. einer abnormen Nierenfunktion. Eine MGRS (monoclonal gammopathy of renal significance) klassifiziert Erkrankungen, die die Kriterien eines MGUS erfüllen, aber eine abnorme Nierenfunktion bzw. Nierenkrankheit, sowie den Nachweis monoklonaler Immunglobulin-Ablagerungen in der Niere (Immunfluoreszenz) aufweisen.
Aktuelles
- Aktuelle Empfehlungen der IMWG zu Diagnose und Management der Myelom-assoziierten Nierenfunktionsverschlechterung wurden 2016 publiziert [3].
- Eine S3-Leitlinie zum Multiplen Myelom wurde 2022 publiziert [15] .
- Die IMWG hat in Differenzierung zum MGUS den Begriff des MGRS (monoclonal gammopathy of renal significance) eingeführt [1].
- Eine Nierenbeteiligung im Sinne einer MGRS ist zumindest in einem Großteil der Fälle als behandlungsbedürftige Organbeteiligung zu werten.
- High-Cutoff-Dialyse: 2 randomiserte Studien zum Einsatz der High-Cutoff-Dialyse (EuLITE-, MYRE-Studie) bei Leichtketten-Cast-Nephropathie lassen eine generelle Empfehlung zum Einsatz der High-Cutoff-Dialyse nicht zu, da beide Studien keinen positiven Effekt der High-Cutoff-Dialyse im Vergleich zu einer effektiven Chemotherapie zeigen konnten.
Synonyme
- Plasmozytom
- Myelomniere
- Zylinder-Nephropathie
- Cast-Nephropathie
Keywords
- Myelom
- Plasmozytom
- Monoklonale Gammopathie
- Monoklonale Gammopathie unklarer Signifikanz (MGUS)
- Monoklonale Gammopathie renaler Signifikanz (MGRS)
Definition
- Ein Multiples Myelom ist charakterisiert durch eine neoplastische Proliferation von Plasmazellen, die ein spezielles monoklonales Immunglobulin produzieren.
- Das Auftreten einer renalen Erkrankung im Rahmen eines Multiplen Myeloms kann verschiedenste Ursachen haben und sich in Abhängigkeit vom pathologischen monoklonalen Protein und dem Ort der renalen Schädigung klinisch unterschiedlich präsentieren.
|
Merke Die aktuellen IMWG-Kriterien [7] für ein symptomatisches Multiples Myelom definieren eine Nierenfunktionsverschlechterung basierend auf folgenden Kriterien (soweit keine andere Nierenkrankheit vorliegt): Serumkreatinin >2 mg/dl, Kreatinin-Clearance <40 ml/min. |
Epidemiologie
- 20-50% aller Patienten mit Multiplem Myelom zeigen zum Zeitpunkt der Erstdiagnose eine eingeschränkte Nierenfunktion im Rahmen einer akuten Nierenfunktionseinschränkung (AKI) oder einer chronischen Nierenerkrankung (CKD).
- Ca. 50% aller Patienten mit Multiplem Myelom entwickeln zu irgendeinem Zeitpunkt im Verlauf ihrer Erkrankung ein AKI oder CKD.
- Eine dialysepflichtige Niereninsuffizienz tritt bei etwa 1-3% (in einzelnen Berichten 10-12%) der Patienten mit Multiplem Myelom auf.
Häufigkeit
- Die Inzidenz des Multiplen Myeloms liegt in Deutschland bei etwa 8 Fällen pro 100.000 Einwohnern pro Jahr.
Altersgipfel
- Das mediane Alter bei Erstdiagnose eines Multiplen Myeloms liegt bei > 70 Jahren.
Geschlechtsverteilung
- Keine Angaben möglich.
Prädisponierende Faktoren
- Keine Angaben möglich.
Ätiologie und Pathogenese
Allgemeine Ätiologie und Pathogenese
- In den meisten Fällen liegt einer Nierenkrankheit bei Patient*innen mit Multiplem Myelom die Produktion eines monoklonalen Immunglobulins oder Immunglobulinfragments (Leichtkette oder Schwerkette) zugrunde.
- Eine Nierenschädigung kann jedoch auch auf von monoklonalen Proteinen unabhängigen Faktoren wie z.B. einer Hyperkalzämie beruhen.
- Die Art der Nierenschädigung (Zylinderbildung, Amyloidablagerung, MIDD) hängt mit den biochemischen Eigenschaften der jeweiligen Leichtkette oder Schwerkette zusammen.
- Spezifische Lambda- bzw. Kappa-Subtypen verursachen einen Großteil der renalen Erkrankungen bei monoklonalen Gammopathien.
- Die klinische Präsentation einer Nierenkrankheit bei Vorliegen eines Multiplen Myeloms oder anderen monoklonalen Gammopathien steht in engem Zusammenhang mit der zugrunde liegenden Ätiologie.
- Intratubuläre Zylinderbildung:
- Leichtketten werden frei im Glomerulus filtriert und durch proximale Tubuluszellen reabsorbiert.
- Während die normale Leichtkettenausscheidung <30 mg/Tag liegt, kann die Ausscheidung beim Multiplen Myelom bis >20 g/Tag ansteigen.
- Durch Bindung an Tamm-Horsfall-Mukoprotein präzipitieren Leichtketten im Tubulus und bilden obstruierende intratubuläre Zylinder und können so zu einer Leichtketten-Cast-Nephropathie führen.
- Verschieden Faktoren wie Volumendepletion, Schleifendiuretika oder niedriger Urin-pH sind in der Lage die intratubuläre Bildung von Zylindern zu aggravieren.
- Direkte Tubulotoxizität:
- im proximalen Tubulussystem kann es durch Reabsorption filtrierter Leichtketten in die Tubuluszelle zur direkten tubulären Schädigung kommen.
- Einige Patient*innen mit Multiplem Myelom entwickeln Zeichen der proximal tubulären Dysfunktion im Sinne eines Fanconi-Syndroms.
- Ablagerung von Leichtketten oder Schwerketten:
- Die Ablagerung von Leichtketten oder Schwerketten in verschiedenen Bereichen der Nieren kann zum Erkrankungsbild einer Immunglobulin-assoziierten Amyloidose oder zur Leichtketten- bzw. Schwerkettenerkrankung der Niere (MIDD) führen.
Leichtketten-Cast-Nephropathie
- Das klinische Bild kann als akute oder chronische Nierenerkrankung imponieren und beruht auf der Überproduktion und Filtration toxischer Leichtketten.
- Eine Leichtketten-Cast-Nephropathie kann die erste Manifestation eines Myeloms darstellen oder auch erst später im Verlauf der Erkrankung auftreten.
- Seltener findet sich eine Leichtketten-Cast-Nephropathie im Rahmen anderer monoklonaler Gammopathien, insbesondere in Assoziation mit einer LCDD (Light Chain Deposition Disease).
- Eine Leichtketten-Cast-Nephropathie ist mit 30-60% die häufigste Ursache einer Nierenbeteiligung bei Patient*innen mit Multiplem Myelom, gefolgt von MIDD bzw. Amyloidose.
- Hervorzuheben ist die Tatsache, dass 25% der Fälle eine nicht mit einem Paraprotein assoziierte Nierenerkrankung aufweisen, z.B. eine akute Tubulusnekrose [6].
- Das Risiko einer Leichtketten-Cast-Nephropathie steht in direktem Zusammenhang mit dem Leichtketten-Subtyp sowie der Konzentration freier Leichtketten (FLC) im Urin.
- Eine Leichtketten-Cast-Nephropathie tritt typischerweise bei hoher Tumorzellaktivität auf; bei niedrigen Konzentrationen freier Leichtketten im Serum (sFLC <500 mg/l) findet sich nur selten eine Leichtketten-Cast-Nephropathie.
AL-Amyloidose
- Bei bis zu 20% aller Patient*innen mit Multiplem Myelom und renaler Beteiligung findet man eine Immunglobulin-assoziierte Amyloidose.
- Eine AL-Amyloidose präsentiert sich typischerweise (>50%) als Proteinurie bzw. nephrotisches Syndrom.
Monoclonal Immunoglobulin Deposition Disease
- Ca. 20% aller Patient*innen mit Multiplem Myelom und renaler Beteiligung weisen eine Monoclonal Immunoglobulin Deposition Disease (MIDD) auf.
- Ähnlich wie bei der Amyloidose zeigen Patient*innen mit Multiplem Myelom und MIDD klinisch typischerweise eine nephrotische Proteinurie, häufig jedoch bereits in Kombination mit einer signifikanten Nierenfunktionseinschränkung.
- Man unterscheidet 3 Subtypen von MIDD basierend auf der Zusammensetzung der Ablagerungen:
- Light Chain Deposition Disease (LCDD),
- Heavy Chain Deposition Disease (HCDD) und
- die kombinierte Form mit Leicht- und Schwerketten (LHCDD).
- Die LCDD stellt mit etwa 80% die häufigste Form bioptisch nachgewiesener MIDD dar.
Hyperkalzämie
- Eine Hyperkalzämie findet sich zum Zeitpunkt der Erstdiagnose bei bis zu 15% aller Patient*innen mit Multiplem Myelom.
- Eine Hyperkalzämie kann über eine Reihe verschiedener Mechanismen wie renaler Vasokonstriktion oder intratubulären Kalziumablagerungen eine akute Nierenfunktionseinschränkung auslösen bzw. begünstigen.
- Darüber hinaus kann eine Hyperkalzämie eine Polyurie mit Volumendepletion bewirken und somit die Toxizität filtrierter freier Leichtketten erhöhen.
- Ein durch eine Hyperkalzämie induziertes akutes Nierenversagen ist bei adäquater Senkung des Serumkalziums häufig reversibel.
Nephrotoxizität
- Kontrastmittelinduziertes akute Nierenfunktionseinschränkung:
- Die Kombination von Hypovolämie, Leichtkettenausscheidung und Röntgenkontrastmittelgabe stellt einen prädisponierenden Faktor für die Entwicklung einer akuten Nierenfunktionseinschränkung dar.
- Nichtsteroidale antiinflammatorische Medikamente (NSAR).
- Bisphosphonate werden bei Patient*innen mit Multiplem Myelom und Knochenläsionen eingesetzt und sind assoziiert mit
- akuter Tubulusnekrose sowie
- einem Subtyp der fokal-segmentalen Glomerulosklerose, der „collapsing“ FSGS.
- In verschiedenen Fallserien wurde unter Lenalidomid oder Carfilzomib über das vermehrte Auftreten von akuten Nierenversagen bei Patient*innen mit Myelom oder Amyloidose berichtet.
Seltene renale Erkrankungen
- Proximale Leichtkettentubulopathie (light chain proximal tubulopathy = LCPT):
- Einige Patient*innen mit Multiplem Myelom entwickeln Zeichen der proximal tubulären Dysfunktion im Sinne eines Fanconi-Syndroms ohne begleitende abnorme Nierenfunktion.
- Bereits ein MGRS kann eine proximale Leichtkettentubulopathie verursachen.
- Die Symptome können der Diagnose eines langsam progredienten Myeloms um Jahre vorausgehen.
- Plasmazellinfiltration:
- Eine ausgeprägte Plasmazellinfiltration der Nieren kann im Rahmen eines Multiplen Myeloms zu einer direkten Verschlechterung der Nierenfunktion führen.
- Tumorlyse-Syndrom.
- Interstitielle Nephritis:
- Ablagerung von Leichtketten an der tubulären Basalmembran.
- Thrombotische Mikroangiopathie unter Einsatz von Proteasominhibitoren wie Bortezomib oder Carfilzomib.
- Hyperviskositätssyndrom.
- Membranoproliferative Glomerulonephritis:
- 30-40% der idiopathischen membranoproliferativen Glomerulonephritiden sind mit der Produktion eines monoklonalen Proteins assoziiert.
- Fibrilläre Glomerulonephritis/Immuntaktoide Glomerulopathie:
- Bis zu 67% aller Patient*innen mit immuntaktoider Glomerulopathie und
- <20% der Patient*innen mit fibrillärer Glomerulonephritis weisen eine monoklonale Gammopathie auf.
Klassifikation und Risikostratifizierung
Monoklonale Gammopathie
- Eine monoklonale Gammopathie (MGUS) geht in den meisten Fällen einem Multiplen Myelom voraus und findet sich bei etwa 3–4% der Bevölkerung im Alter >50 Jahre.
- Diagnose eines MGUS:
- Plasmazellanteil <10% im Knochenmark und
- Fehlen von CRAB-Kriterien.
- Also: Eine Nierenfunktionseinschränkung auf Basis einer monoklonalen Gammopathie schließt die Diagnose MGUS aus.
- Die Progressionsrate eines MGUS zum Multiplen Myelom liegt bei 0,5–1% pro Jahr.
- Die IMWG definiert seit 2014 3 verschiedene Typen eines MGUS (Tab. 7.8):
- Etwa 80% aller Multiplen Myelome entwickeln sich aus einem Non-IgM-MGUS und
- 20% entwickeln sich aus einem Leichtketten-MGUS.
- Einem IgM-MGUS folgt in aller Regel eine Waldenström-Makroglobulinämie.
| Tab. 7.8 Diagnostische Kriterien für Monoklonale Gammopathien unklarer Signifikanz [7]. |
| Art der monoklonalen Gammopathie | Definition |
| Non-IgM-MGUS | Serum: Monoklonales Protein (non-IgM) <30 g/l Knochenmark: Klonale Plasmazellen <10% Fehlen von Endorganschäden (CRAB: Hyperkalzämie, abnorme Nierenfunktion, Anämie, Knochenläsionen) oder Amyloidose |
| IgM-MGUS | Serum: Monoklonales IgM-Protein <30 g/l Knochenmark: lymphoplasmozytische Infiltration <10% Kein Hinweis auf Anämie, Hyperviskosität, Lymphadenopathie, Hepatosplenomegalie, Allgemeinsymptome oder Endorganschäden, die durch die zugrunde liegende lymphoproliferative Erkrankung hervorgerufen werden. |
| Leichtketten-MGUS | Auffällige FLC-Ratio (<0,26 oder >1,65) Erhöhte Konzentration der jeweiligen sFLC (Κ FLC, wenn Ratio >1,65, λ FLC, wenn Ratio <0,26) Fehlende Schwerkettenexpression in der Immunfixation Fehlen von Endorganschäden (CRAB: Hyperkalzämie, Niereninsuffizienz, Anämie, Knochenläsionen) oder Amyloidose Knochenmark: klonale Plasmazellen <10% Monoklonales Protein im Urin <500 mg/24 h |
| FLC: free light chain |
Monoklonale Gammopathie mit renaler Signifikanz
- Eine monoklonale Gammopathie mit renaler Signifikanz (MGRS) klassifiziert Erkrankungen, die die Kriterien eines MGUS erfüllen, aber eine abnorme Nierenfunktion bzw. Nierenerkrankung sowie den Nachweis monoklonaler Immunglobulin-Ablagerungen in der Niere mittels Immunfluoreszenz aufweisen (Tab. 7.9).
- Eine MGRS erfüllt noch nicht die Kriterien für ein Multiples Myelom oder eine lymphoproliferative Erkrankung und kann assoziiert sein mit anderen hämatologischen Erkrankungen wie z.B. SMM, smoldering Waldenström oder monoklonaler B-Zell Lymphozytose
- Die Ablagerung oder Präzipitation monoklonaler Immunglobuline in der Niere ist nicht auschließlich der AL-Amyloidose vorbehalten, sondern auch mit einer Reihe weiterer Nierenerkrankungen assoziiert, wie
- MIDD (monoclonal immunoglobulin deposition disease),
- proximale Leichtketten-Tubulopathie oder
- proliferative Glomerulonephritiden.
| Tab. 7.9 Monoklonale Gammopathie renaler Signifikanz (MGRS): Krankheitsbilder. |
|
AL-Amyloidose AH-Amyloidose AHL-Amyloidose |
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck und Hämaturie selten |
||
|
Immunotaktoide Glomerulonephritis/GOMMID |
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck, Mikrohämaturie |
||
|
Typ I kryoglobulinämische Glomerulonephritis |
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck, Mikrohämaturie, ggf. nephritisches Syndrom, AKI + Anurie |
||
|
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck, Mikrohämaturie |
|||
|
Proliferative Glomerulonephritis mit monoklonalen Ig-Ablagerungen |
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck, Mikrohämaturie |
||
|
Proteinurie, nephrotisches Syndrom, CKD, Hochdruck, Mikrohämaturie |
|||
|
Hypourikämie, Hypophosphatämie, normoglykämische Glukosurie, Aminoazidurie, proximale Typ-2 renal-tubuläre Azidose, niedrigmolekulare Proteinurie, langsam-progrediente CKD |
|||
|
Tubuläre Proteinurie, progrediente CKD |
|||
| GOMMID: glomerulonephritis with organized microtubular monoclonal immunoglobulin deposits; CKD: chronic kidney injury; AKI: acute kidney injury; MIDD: monoclonal immunoglobulin deposition disease |
Multiples Myelom
- Klinisch unterscheidet man auf der Basis der Konzentration des monoklonalen Proteins sowie des Plasmazellanteils MGUS, „Smouldering“ Myelom und Multiples Myelom.
- Definition Multiples Myelom:
- Knochenmark: klonale Plasmazellen ≥10% oder bioptisch (Knochen oder extramedullär) nachgewiesenes Plasmozytom + ein oder mehrere der folgenden Myelom-definierenden Ereignisse:
- Myelom-definierende Ereignisse:
| Merke
Ein Multiples Myelom wird auf der Basis verschiedener Myelom-definierender Ereignisse oder durch das Vorliegen spezifischer Biomarker diagnostiziert. Eine Nierenfunktionseinschränkung stellt ein Myelom-definierendes Ereignis dar. |
- Definition Smouldering Myelom:
- Vorliegen folgender Kriterien:
- Monoklonales Protein im Serum (IgG oder IgA) ≥30 g/l oder monoklonales Protein im Urin >500 mg/24 h und/oder klonale Plasmazellen im Knochenmark 10–60%,
- Fehlen von Myelom-definierenden Ereignissen oder Amyloidose.
- Das „Smouldering“ Myelom ist durch eine höhere Progressionsrate von 10% in den ersten 5 Jahren nach Diagnose charakterisiert.
- Auch hier dürfen noch keine CRAB-Kriterien inkl. einer Nierenfunktionseinschränkung vorliegen.
- Ein „Smouldering“ Myelom kann jedoch eine MGRS darstellen
Symptomatik
- Akute bzw. subakute Niereninsuffizienz:
- Etwa 20–50% aller Patient*innen mit Multiplem Myelom zeigen zum Zeitpunkt der Erstdiagnose ein erhöhtes Serumkreatinin.
- Meistens liegt einem akuten Nierenversagen eine Cast-Nephropathie zugrunde.
- Chronische Niereninsuffizienz:
- Bei einem Teil der Patient*innen mit Multiplem Myelom kommt es im Verlauf zu einem graduellen oder progressiven Anstieg des Serumkreatinins.
- Eine chronisch verlaufende Niereninsuffizienz findet man eher bei Patient*innen mit AL-Amyloidose, MIDD oder inkompletter Erholung der Nierenfunktion nach Auftreten einer Cast-Nephropathie.
- Proteinurie bzw. nephrotisches Syndrom:
- Eine Albuminurie bzw. ein nephrotisches Syndrom findet man typischerweise bei Patient*innen mit Amyloidose oder MIDD.
- Die Proteinurie besteht:
- bei Leichtketten-Zylindernephropathie überwiegend aus monoklonalen Immunglobulinen (Bence-Jones-Proteinurie),
- bei der AL-Amyloidose bzw. der MIDD ist der Anteil monoklonaler Leichtketten im Urin eher gering.
- Elektrolytstörungen:
- Am häufigsten findet sich im Rahmen eines Multiplen Myeloms eine Hyperkalzämie (10–15%).
- Seltener kommt zum Auftreten eines partiellen oder kompletten Fanconi-Syndroms.
| Cave
Zu beachten ist, dass eine ausgeprägte Hyperproteinämie beim Multiplen Myelom eine Pseudohyponatriämie verursachen kann. |
Diagnostik
Diagnostisches Vorgehen
- Im Rahmen der Diagnostik sollte geklärt werden, inwieweit das nachgewiesene monoklonale Protein für die Pathogenese der Nierenkrankheit verantwortlich ist. Dies gelingt meist nur mittels Nierenbiopsie (Abb. 7.15).
- Häufig ist zum Zeitpunkt der Nierenbiopsie die hämatologische Grunderkrankung noch nicht bekannt.
- In einzelnen Fällen kann bei bereits etablierter Diagnose eines Multiplen Myeloms bzw. einer renalen AL-Amyloidose auf eine Nierenbiopsie verzichtet werden.
- Sowohl in der Initialdiagnostik als auch im Rahmen der Therapiesteuerung ist der Nachweis monoklonaler Proteine mit verschiedenen Testverfahren wichtig.
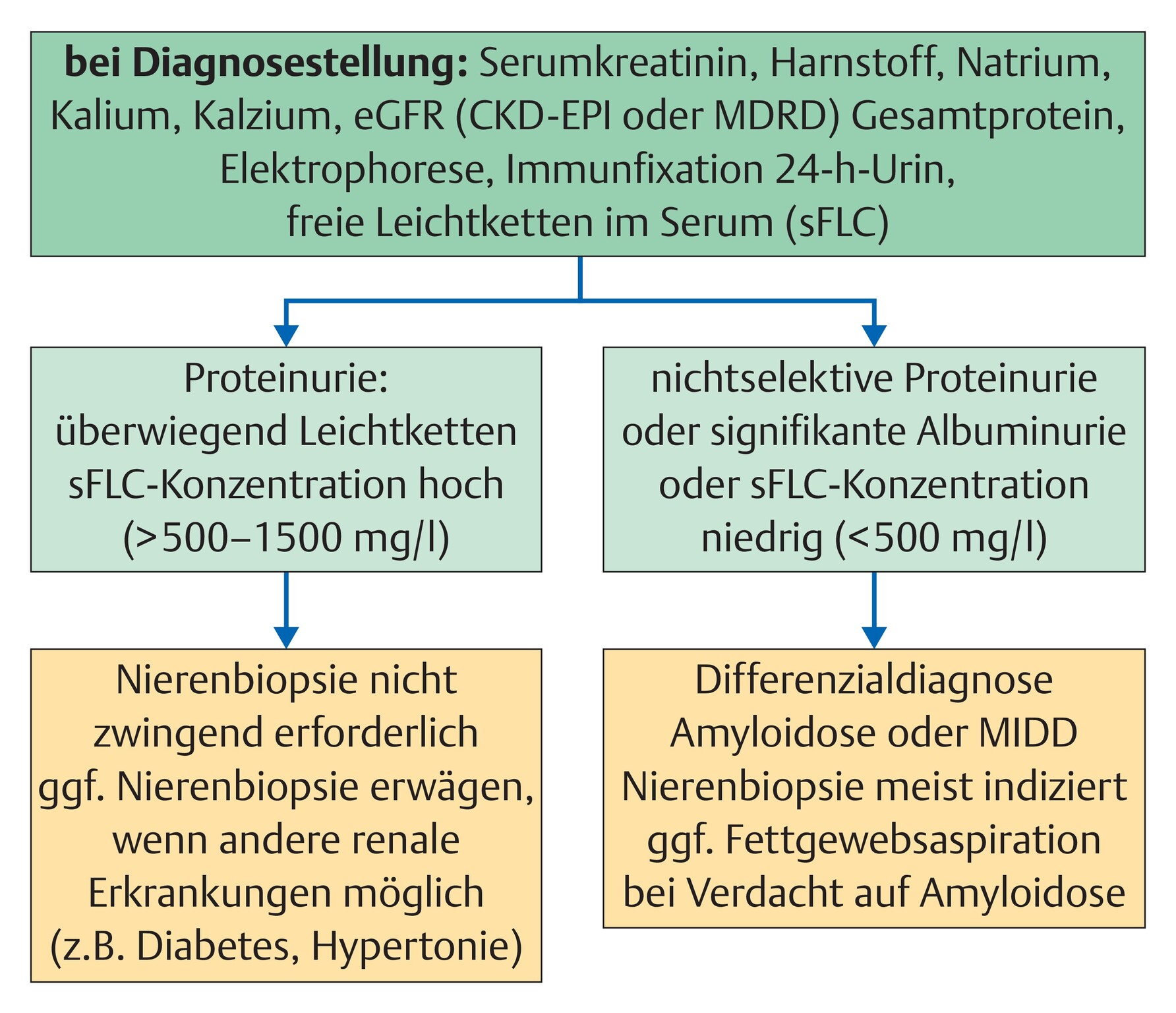 Quelle: Quelle: Beimler J. Multiples Myelom und MGUS. In: Alscher M, Hrsg. Referenz Nephrologie. 1. Auflage. Stuttgart: Thieme; 2019. doi:10.1055/b-005-143660
Quelle: Quelle: Beimler J. Multiples Myelom und MGUS. In: Alscher M, Hrsg. Referenz Nephrologie. 1. Auflage. Stuttgart: Thieme; 2019. doi:10.1055/b-005-143660
Abb. 7.15 Multiples Myelom und MGUS.
Diagnostisches Vorgehen bei Verdacht auf renale Beteiligung im Rahmen einer monoklonalen Gammopathie bzw. eines Multiplen Myeloms.
Anamnese
- Die Anamnese einer renalen Beteiligung beim Multiplen Myelom ist unspezifisch bzw. entspricht der jeweiligen Klinik des akuten bzw. chronischen Nierenversagens. Myelom-typisch sind darüberhinaus insbesondere Knochenschmerzen, Fatigue, Infektneigung, Gewichtsverlust, Polyneuropathie, venöse Thrombembolien oder Blutungs- und Anämiezeichen.
Körperliche Untersuchung
- Die körperliche Untersuchung bleibt meist unspezifisch. Bei fortgeschrittenem Nierenversagen und/oder großer Proteinurie finden sich schäumender Urin und Ödeme.
Labor
Bestimmung freier Leichtketten im Serum
- Die Bestimmung freier Leichtketten im Serum (sFLC) erfolgt mittels Immunoassay und quantifiziert die Konzentration zirkulierender freier Kappa- und Lambda-Leichtketten.
- Analog können mit einem speziellen Assay auch Schwerketten detektiert werden.
- Neben der Erhöhung freier Leichtketten im Serum gilt ein pathologisches Verhältnis von Kappa- und Lambda-Leichtketten als Indikator für eine monoklonale Leichtkettenerkrankung.
- Als sensitiver Marker für die Klonalität der Erkrankung wird die Kappa/Lambda-Ratio der freien Leichtketten bestimmt.
| Merke
Das normale Verhältnis von Kappa- zu Lambda-Leichtketten im Serum liegt bei 0,26–1,65, wenn keine Einschränkung der Nierenfunktion vorliegt. Bei Einschränkung der Nierenfunktion erhöht sich der obere Normwert der Kappa/Lambda-Ratio auf 3,1. |
- Die Bestimmung von sFLC mittels Immunoassay ist wesentlich sensitiver als die Bestimmung freier Leichtketten mittels Urin-Eiweißelektrophorese (Bence-Jones-Proteine).
| Merke
Bei sFLC >1500 mg/l und unklarer Nierenfunktionseinschränkung <6 Monaten besteht der hochgradige Verdacht auf eine Leichtketten-Cast-Nephropathie. Eine Leichtketten-Cast-Nephropathie ist hingegen unwahrscheinlich bei Patienten mit sFLC <500 mg/l. |
Serum-Proteinelektrophorese + Immunfixation
- Die Serum-Proteinelektrophorese bzw. Immunfixation kann intakte monoklonale Immunglobuline (Leicht- und Schwerketten) nachweisen.
Urin-Proteinelektrophorese + Immunfixation
- Die Urin-Proteinelektrophorese bzw. Immunfixation erlaubt den Nachweis und die Quantifizierung der Proteinausscheidung und somit die Einschätzung des Verhältnisses von Albumin- zu monoklonaler Leichtkettenausscheidung.
- Bei Leichtketten-Cast-Nephropathie besteht die Urin-Proteinausscheidung überwiegend aus Leichtketten, während deren Anteil bei Amyloidose oder MIDD im Vergleich zur Albuminausscheidung eher gering ist.
- Ist die vorliegende Nierenerkrankung nicht mit der Plasmazellerkrankung assoziiert, findet sich lediglich eine Albuminurie.
Sonstige Labordiagnostik
- Einschätzung der Nierenfunktion mittels Serumkreatinin, Harnstoff + eGFR (MDRD oder CKD-EPI)
- Die Einschätzung des Nierenfunktionsverlaufs bei Patient*innen mit Multiplem Myelom oder anderen monoklonalen Gammopathien folgt den gültigen Definitionen für akutes Nierenversagen (AKIN bzw. RIFLE) bzw. chronische Niereninsuffizienz (CKD Stadien I–V).
- Urinsediment-Analyse inkl. Phasenkontrastmikroskopie
- Serumkalzium, -Harnsäure, -Elektrolyte inkl. Phosphat
Bildgebende Diagnostik
Sonografie
- Sonografie der Nieren zum Ausschluss einer obstruktiven Nephropathie.
- Bei direkter Plasmazellinfiltration lassen sich in seltenen Fällen deutlich vergrößerte Nieren finden.
Histologie, Zytologie und klinische Pathologie
Nierenbiopsie
- Eine Nierenbiopsie
- ermöglicht die histologische Sicherung der einer Nierenfunktionsstörung zugrunde liegenden renalen Pathologie,
- erlaubt bei Vorliegen einer Myelom-assoziierten Nierenerkrankung eine bessere Steuerung der Therapie,
- erlaubt die Unterscheidung zwischen Leichtketten-Cast-Nephropathie und anderen Formen einer Myelom-assoziierten Nierenerkrankung wie MIDD oder Amyloidose,
- erfasst auch nicht mit einer monoklonalen Gammopathie assoziierte Veränderungen wie interstitielle Nephritis oder ATN.
- Unter bestimmten Umständen kann ein Verzicht auf eine Nierenbiopsie in Betracht gezogen werden:
- Patient*innen mit wahrscheinlicher Diagnose einer Leichtketten-Cast-Nephropathie (s.u.),
- Patient*innen mit Albuminurie oder nephrotischem Syndrom und bereits etablierter Diagnose einer AL-Amyloidose (z.B. durch Fettgewebsaspiration),
- Patient*innen mit monoklonaler Gammopathie oder Multiplem Myelom und klinischem Bild eines Fanconi-Syndroms.
- Die aktuelle S3 Leitlinie zum Multiplen Myelom empfiehlt folgendes Vorgehen zur Nierenbiopsie [15] :
- Eine Nierenbiopsie zur Klassifikation der Form der renalen Beteiligung und Abgrenzung gegenüber anderen Nierenerkrankungen sollte durchgeführt werden, wenn Zeichen eines renalen Endorganschadens* vorhanden sind, der fachnephrologisch nicht eindeutig zuzuordnen ist
- Bei einer monoklonalen Gammopathie unbestimmter Signifikanz (MGUS) oder einem Smouldering Myeloma sollte eine Nierenbiopsie erfolgen, wenn Zeichen einer Nierenschädigung (eGFR-Verlust, pathologischer Albumin/KreatininQuotient, Erythrozyturie/Hämaturie (ohne Hinweis auf eine Quelle in den ableitenden Harnwegen), renal-tubuläre Azidose oder Zeichen einer proximalenTubulus-Dysfunktion) vorliegen.
- Das Vorliegen einer monoklonalen Gammopathie renaler Signifikanz (MGRS) stellt in den meisten Fällen eine Behandlungsindikation der zugrundeliegenden Plasmazelldyskrasie oder lymphoproliferativen Erkrankung dar und darf deshalb nicht übersehen werden.
| Merke
Aktuelle Guidelines verzichten unter bestimmten Vorgaben auf die Empfehlung zur Durchführung einer Nierenbiopsie. Die wahrscheinliche Diagnose einer Leichtketten-Cast-Nephropathie kann unter folgenden Bedingungen ohne Durchführung einer Nierenbiopsie angenommen werden:
Die Empfehlung zur Biopsie besteht somit bei auffälligem Urinsediment, sFLC < 500 mg/l oder Überwiegen der Albuminurie in der 24-Stunden-Urin-Elektrophorese mit Immunfixation. |
Differenzialdiagnosen
- In erster Linie alle mit monoklonalen Gammopathien bzw. Multiplem Myelom assoziierten renalen Erkrankungen, wie unter Kap. Ätiologie und Pathogenese erwähnt.
- Nierenkrankheiten mit akuter/subakuter Verschlechterung der Nierenfunktion, die nicht mit monoklonalen Gammopathien assoziiert sind.
- Nierenkrankheiten mit führender Albuminurie und/oder nephrotischem Syndrom, die auch bei Patient*innen ohne monoklonale Gammopathie auftreten (z.B. diabetische Nephropathie, membranöse Glomerulonephritis, FSGS).
- Andere Nierenkrankheiten mit Elektrolytstörungen im Sinne eines Fanconi-Syndroms.
Therapie
Therapeutisches Vorgehen
- Die Therapie der Myelom-assoziierten Nierenkrankheiten, insbesondere der Leichtketten-Cast-Nephropathie, basiert in erster Linie auf einer gegen das Multiple Myelom gerichteten Chemotherapie.
- Ziel ist eine möglichst rasche Reduktion pathogener freier Leichtketten.
- Insbesondere neue medikamentöse Therapieoptionen haben in den letzten Jahren die sequentielle Therapie des Multiplen Myeloms verbessert [11].
- Die IMWG hat Kriterien für die Definition eines renalen Ansprechens unter Therapie definiert (Tab. 7.10) [4].
| Tab. 7.10 Kriterien für die Definition eines renalen Ansprechens im Rahmen der Myelomtherapie [4]. |
| Renales Ansprechen | Baseline eGFR (ml/min/1,73 m2) | Bestes Ansprechen der Kreatinin-Clearance |
| Komplettes Ansprechen (CR) | <50 | ≥60 ml/ min |
| Partielles Ansprechen (PR) | <15 | 30–59 ml/min |
| Minor Ansprechen (MR) | <15 | 15–29 ml/min |
| Minor Ansprechen (MR) | 15–29 | 30–59 ml/min |
| eGFR auf Basis der MDRD- oder CKD-EPI-Formel |
Allgemeine Maßnahmen
- Symptomatische Therapiemaßnahmen [255] umfassen Flüssigkeitsmanagement, Vermeiden nephrotoxischer Substanzen sowie den Ausgleich von Elektrolytstörungen.
- Flüssigkeitsmanagement:
- Soweit keine Kontraindikationen vorliegen, sollte eine adäquate orale bzw. intravenöse Flüssigkeitssubstitution erfolgen.
- Ziel ist eine tägliche Urinausscheidung von etwa 2,5–3 l, um die Leichtkettenkonzentration im Tubuluslumen zu senken und somit die Präzipitation von Leichtketten zu minimieren.
- Vermeidung nephrotoxischer Substanzen.
- Ausgleich von Elektrolytstörungen.
- Zurückhaltender Einsatz von Schleifendiuretika (außer bei Hyperkalzämie); Schleifendiuretika fördern bei Volumendepletion die Castbildung.
Pharmakotherapie
| Merke
Die SLiM-CRAB-Kriterien der IMWG [7] bilden die Grundlage für den Beginn einer medikamentösen Therapie des Multiplen Myeloms. Ein MGUS mit Organbeteiligung sollte eine Biopsie des betroffenen Organs zur Folge haben. Im Falle einer renalen Beteiligung im Sinne eines MGRS kann dies im Einzelfall zur Therapieentscheidung führen. |
Therapie der Hyperkalzämie
- Die Therapie der Hyperkalzämie im Rahmen eines Multiplen Myeloms folgt den generellen Empfehlungen zur Behandlung einer Hyperkalzämie.
| Cave
Vorsicht ist geboten beim Einsatz von Bisphosphonaten oder Denosumab bei eingeschränkter Nierenfunktion. Neben dem Risiko einer Hypokalzämie sind unter dem Einsatz von Bisphosphonaten eine Sonderform der FSGS („collapsing FSGS“) mit AKI und nephrotischem Syndrom sowie eine akute Tubulusnekrose beschrieben worden. |
Chemotherapie/Stammzelltransplantation
- Zeitnaher Beginn der Chemotherapie, um eine rasche Reduktion der sFLC zu erreichen.
- Die Therapie wird bei der Erstdiagnose von Patient*innen, die für eine Transplantation geeignet sind, in Induktion, autologe Transplantation, Konsolidierung und Erhaltung unterteilt.
- Die Hochdosistherapie mit autologer Stammzelltransplantation führt auch mit neueren Therapieoptionen in der Erstlinientherapie zu einer Erhöhung der Rate kompletter Remissionen, Verbesserung der Ansprechtiefe und längerer progressionsfreien Überlebenszeit gegenüber einer ausschließlich medikamentösen Therapie.
- Der Algorithmus für die Erstlinientherapie basiert zunächst auf der Eignung der Patient*innen für eine Hochdosistherapie.
- Kombinationstherapien mit neueren Substanzen wie Thalidomid, Bortezomib und Lenalidomid in der Induktionstherapie verbessern die Ansprechraten vor und nach Stammzelltransplantation im Vergleich zur klassischen, nicht mehr empfohlenen Vincristin-Anthrazyklin-haltigen Induktionstherapie.
- Die Erhaltungstherapie mit dem Immunmodulator Lenalidomid führt zur Verlängerung der Gesamtüberlebenszeit im Vergleich zu Beobachtung ohne Therapie. Bei Hochrisikopatienten mit Niereninsuffizienz oder mit prognostisch ungünstiger Zytogenetik kann nach einer Bortezomib-haltigen Induktion und Hochdosistherapie mit autologer Stammzelltransplantation eine Bortezomib-Erhaltungstherapie über 2 Jahre erwogen werden.
- Bei Patient*innen, die nicht für eine Stammzelltransplantation geeignet sind, kann in der Erstlinientherapie neben Bortezomib auch Melphalan eingesetzt werden. Eine Alternative ist die kontinuierliche immunmodulatorische Therapie mit Lenalidomid und Dexamethason.
- In der Zweitlinientherapie richtet sich die Wahl der Arzneimittel neben den Zulassungsbedingungen auch nach der Wirksamkeit der Erstlinientherapie und der Verträglichkeit. Bei geringer Wirksamkeit und/oder schlechter Verträglichkeit ist ein Wechsel der Substanzklasse indiziert.
- Neuere Therapieotionen sowie deren mögliche Kombinationen sind sehr vielfältig und erlauben auch das Krankheitsbild, Vortherapie(n) und Komorbiditäten angepasste Sequenztherapien.
- Algorithmen für die Erstlinientherapie sowie die Therapie im Rezidiv oder bei Refraktärität können aktuellen Guidelines entnommen werden [11] [14] [15] .
- Eine Dosisanpassung der Chemotherapeutika erfolgt entsprechend der Nierenfunktion. Bei Vorliegen einer eingeschränkten eGFR sollen Medikamente gemäß der Fachinformationen oder entsprechender Dosierungshilfen (z.B. www.dosing.de) an die eGFR angepasst werden. Aufgrund der oft unzureichenden Datenlage zur Dosisreduktion bei Niereninsuffizienz bleiben Dosisanpassungen oft individuelle Therapieentscheidungen.
- Ein Bortezomib-haltiges Regime kann in Abhängigkeit vom hämatologischen Ansprechen ein komplettes renales Ansprechens mit einem eGFR-Anstieg auf > 60 ml/min bewirken. Im Vergleich mit Thalidomid- und Lenalidomid-haltigen Regimen ist die Dauer bis zum Erreichen eines deutlichen renalen Ansprechens mit Bortezomib am kürzesten und ausgeprägtesten.
- Da der extrarenal ausgeschiedene bioverfügbare Dosisanteil bei normaler Nierenfunktion von Bortezomib hoch ist, ist keine Dosisanpassung bei eingeschränkter Nierenfunktion notwendig.
- Lenalidomid wird zu über 80 % renal eliminiert. Eine nierenfunktionsadaptierte Gabe scheint zumindest bei Patient*innen mit milder bis mäßiggradiger Nierenfunktionseinschränkung ohne exzessive Toxizität einherzugehen und unabhängig von der Nierenfunktionsstörung eine gutes Therapieansprechen erreichen zu können.
- Thalidomid dagegen wird nicht renal eliminiert und muss nicht dosisadaptiert werden.
- Auch für Pomalidomid, Ixazomib, Carfilzomib, Elotuzumab oder Daratumumab liegen Daten zur Anwendung bei Patient*innen mit Nierenfunktionsstörung vor [15]
| Richtlinien
Die aktuelle S3 Leitlinie zum Multiplen Myelom empfiehlt u.a. folgendes Vorgehen bei renaler Beteiligung im Rahmen eines Multiplen Myeloms [15] :
|
Interventionelle Therapie
Extrakorporale Elimination von Leichtketten
- Aktuelle Leitlinien (S3 Leitlinie) empfehlen keine extrakorporale Leichtkettenelimination: Eine Dialysebehandlung mittels high cut-off Dialysemembranen oder eine Plasmapherese ausschließlich zum Zweck der Reduktion der Serum-Leichtkettenlast soll nicht erfolgen [15] .
- Der Einsatz eines Nierenersatzverfahrens folgt den üblichen Kriterien wie Volumenüberladung, Hyperkaliämie oder Urämie.
- Der Einsatz extrakorporaler Verfahren zur Leichtkettenelimination erfolgte bislang typischerweise bei Patient*innen mit dialysepflichtigem akutem Nierenversagen und Nachweis einer Leichtketten-Cast-Nephropathie.
| Cave
Der Einsatz extrakorporaler Verfahren zur Leichtkettenelimination wird nicht empfohlen und kontrovers diskutiert, da der Benefit dieses Behandlungsverfahrens in 2 aktuellen randomisierten Studien (MYRE, EuLITE) nicht ausreichend belegt werden konnte. |
- Plasmapherese:
- Die Plasmapherese wird typischerweise als klassische Plasmaseparation mit Volumenersatz durch Albumin durchgeführt.
- Das Plasmapherese-Regime zur Leichtkettenelimination umfasst in aller Regel 5–7 Behandlungen innerhalb von 7–10 Tagen [8].
- Der Benefit einer Plasmapherese hinsichtlich des renalen Outcomes wird kontrovers diskutiert: Aufgrund differierender Ergebnisse methodisch nicht ausgereifter Studien kann derzeit keine Empfehlung für den routinemäßigen Einsatz der Plasmapherese gegeben werden.
- Aufgrund potenzieller Komplikationen bleibt die Plasmaaustauschbehandlung entsprechend den Empfehlungen der American Society for Apheresis symptomatischen Patienten mit Hyperviskositätssyndrom und kryoglobulinämischer Vaskulitis vorbehalten.
- High-Cutoff-Dialyse:
- Der Einsatz der HCO-Hämodialysemembran erlaubt die Elimination von Leichtketten.
- Behandlungsschema:
- Behandlungsdauer von jeweils 8 h an den ersten 5 Tagen sowie an alternierenden Tagen für weitere 12 Tage.
- Im Anschluss erfolgen 6-stündige Behandlungen 3-mal/Woche [5].
- Zur Anwendung von High-cut-off(HCO)-Membranen beim Plasmozytom wurden aktuell 2 randomisierte Studien mit negativen Ergebnissen publiziert:
- EuLITE-Studie [5]: Der Einsatz der HCO-Dialyse konnte in dieser Phase 2 Studie das klinische Outcome von Patient*innen mit neu diagnostiziertem Multiplem Myelom, Cast Nephropathie und dialysepflichtigem akuten Nierenversagen nicht verbessern. Alle Patient*innen erhielten eine Bortezomib-basierte Chemotherapie.
- MYRE-Studie [10]: Der primäre Endpunkt die Dialysefreiheit nach 3 Monaten wurde nicht erreicht, er war in der HCO-Gruppe mit 41% nicht signifikant niedriger als in der High-flux-Gruppe mit 33%. Allerdings war die Dialysefreiheit nach 6 und 12 Monaten signifikant höher für die HCO-Membran im Vergleich mit der High-flux“ Membran.
| Praxistipp
Die aktuelle S3 Leitlinie zum Multiplen Myelom empfiehlt keinen Einsatz einer extrakorporalen Leichtkettenelimination. Guidelines der IMWG aus dem Jahr 2016 unterstützten den Einsatz der High-Cutoff-Dialyse in Kombination mit einer Chemotherapie bei Patient*innen mit AKI und Leichtketten-Cast-Nephropathie (Grad-B-Empfehlung). Alternativ wurde der Einsatz der Plasmapherese bei Nichtverfügbarkeit vorgeschlagen (Grad C). Die aktuell publizierten negativen Ergebnisse der MYRE- Studie bzw. EuLITE-Studie lassen jedoch Zweifel am Einsatz der High-Cutoff-Dialyse aufkommen. |
Zellbasierte Verfahren
Stammzelltransplantation
- Abnorme Nierenfunktion:
- In Abhängigkeit von den üblichen Einschlusskriterien kann auch bei bestehender Einschränkung der Nierenfunktion eine Stammzelltransplantation in Betracht gezogen werden.
- Eine bestehende abnorme Nierenfunktion gilt nicht mehr als absolute Kontraindikation für eine autologe Stammzelltransplantation.
- Einzelne Studien haben den sicheren Einsatz bei Dialysepflichtigkeit gezeigt.
- Die Melphalandosis wird üblicherweise auf 100–140 mg/m2 reduziert.
Operative Therapie
Nierentransplantation
- In einzelnen Fällen kann bei anhaltender Remission der monoklonalen Grunderkrankung eine Nierentransplantation in Betracht gezogen werden.
- Die Erfahrungen zur Nierentransplantation bei Myelompatient*innen oder anderen monoklonalen Gammopathien sind begrenzt. Eine Nierentransplantation bleibt daher immer eine Einzelfallentscheidung.
- Grundbedingung für eine Nierentransplantation ist eine adäquate Kontrolle der Leichtkettenproduktion, denn bei fehlender Kontrolle der Leichtkettenproduktion resultiert eine hohe Rekurrenzrate im Transplantat bis hin zur Progression zum Multiplen Myelom.
- Eine allogene Nierentransplantation kann bei Patient*innen mit Multiplem Myelom und terminaler Niereninsuffizienz als Einzelfallentscheidung erwogen werden, wenn mindestens eine very good partial response (VGPR) über 12 Monate erreicht worden ist.
- Auch bei Patient*innen mit MGRS bleibt die Nierentransplantation eine Einzelfallentscheidung soweit eine ausreichende Remission der monoklonalen Gammopathie erreicht werden kann [16] .
- Auch bei Patient*innen nach erfolgter Stammzelltransplantation mit komplettem hämatologischem Ansprechen ist eine Nierentransplantation möglich, kombinierte Stammzell- und Nierentransplantationen wurden in Einzelfällen erfolgreich durchgeführt.
- Die Entscheidung zur Transplantation sollte in einem interdisziplinären Team aus Hämatoonkolog*innen und (Transplant)-Nephrolog*innen erfolgen.
Nachsorge
- Patient*innen mit chronischer Nierenfunktionseinschränkung nach Diagnose einer Leichtketten-Cast-Nephropathie sollten routinemäßige Bestimmungen der sFLC erhalten, da bei Anstieg der sFLC im Verlauf ein Rezidiv der Cast-Nephropathie auftreten kann.
Verlauf und Prognose
- Das Patientenüberleben korreliert mit dem Auftreten bzw. dem Schweregrad der Nierenfunktionseinschränkung [13].
- Insbesondere dialysepflichtige Patient*innen mit Multiplem Myelom zeigen eine deutlich geringere Überlebensrate (30% nach 1 Jahr und 10% nach 3 Jahren).
- Neuere Therapieverfahren haben das Patientenüberleben deutlich verbessert, obwohl bei schwerer Nierenfunktionseinschränkung das Risiko früh zu versterben weiterhin erhöht ist [2].
- Patient*innen mit terminaler dialysepflichtiger Niereninsuffizienz (ESRD) und Multiplem Myelom, die die ersten 2 Monate überleben, zeigen ein 1-Jahres-Überleben von etwa 45% und 25-30% nach 2 respektive 3 Jahren.
- Unter verschiedenen Therapien wurde ein renales Ansprechen in einem Bereich von 50-80% berichtet.
- Insbesondere bei Ansprechen der Chemotherapie verbessert sich die Prognose von Patient*innen mit ESRD.
- Eine Erholung der Nierenfunktion unter Therapie wirkt sich bei Patient*innen mit Multiplem Myelom und AKI prognostisch positiv aus, das mediane Patientenüberleben verlängert sich.
Quellenangaben
- [1] Leung N, Bridoux F, Batuman V. The evaluation of monoclonal gammopathy of renal significance: a consensus report of the International Kidney and Monoclonal Gammopathy Research Group. Nature Reviews Nephrology 2019; 15: 45
Suche in: PubMed Google Scholar - [2] Dimopoulos MA, Delimpasi S, Katodritou E et al. Significant improvement in the survival of patients with multiple myeloma presenting with severe renal impairment after the introduction of novel agents. Ann Oncol 2014: 25: 195
Suche in: PubMed Google Scholar - [3] Dimopoulos MA, Sonneveld P, Leung N et al. IMWG Recommendations for the Diagnosis and Management of Myeloma-Related Renal Impairment. J Clin Oncol 2016: 34: 1544
Suche in: PubMed Google Scholar - [4] Dimopoulos MA, Terpos E, Chanan-Khan A et al. Renal impairment in patients with multiple myeloma: a consensus statement on behalf of the IMWG. J Clin Oncol 2010: 28: 4976
Suche in: PubMed Google Scholar - [5] Hutchison CA, Cockwell P, Moroz V et al. High cutoff versus high-flux haemodialysis for myeloma cast nephropathy in patients receiving bortezomib-based chemotherapy (EuLITE): a phase 2 randomised controlled trial. Lancet Haematol 2019; 6: e217
Suche in: PubMed Google Scholar - [6] Nasr SH, Valeri AM, Sethi S et al. Clinicopathologic correlations in multiple myeloma: a case series 190 patients with kidney biopsies. Am J Kidney Dis 2012; 59: 786
Suche in: PubMed Google Scholar - [7] Rajkumar SV, Dimopoulos MA, Palumbo A et al. IMWG updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014: 15: e538
Suche in: PubMed Google Scholar - [8] Yu X, Gan L, Wang Z et al. Chemotherapy with or without plasmapheresis in acute renal failure due to multiple myeloma. A meta analysis. Int J Clin Pharmacol Ther 2015: 53: 391
Suche in: PubMed Google Scholar
Herausgeber*innen, Autor*innen
Herausgeber: Mark Dominik Alscher
Autor: Jörg Beimler
Letzte Änderung: 28.06.2023