Plasmozytom des Knochens/Multiples Myelom
Radiologie
Inhaltsverzeichnis
- Steckbrief
- Synonyme
- Keywords
- Definition
- Epidemiologie
- Ätiologie und Pathogenese
- Klassifikation und Risikostratifizierung
- Symptomatik
- Methode der Wahl
- Pathognomonische Befunde
- Befundbeschreibung
- Radiologische Differenzialdiagnose
- Typische Fehler
- Was der*die zuweisende Kolleg*in/Kliniker*in wissen muss
- Prognose
- Quellenangaben
- Literatur zur weiteren Vertiefung
- Herausgeber*innen, Autor*innen
Steckbrief
Das multiple Myelom wird zu der Gruppe der B-Non-Hodgkin-Lymphome gezählt und ist gekennzeichnet durch eine neoplastische Proliferation von Plasmazellen. Unterschieden werden das Plasmozytom (solitärer Herd), das multiple Myelom (multizentrisch) und das extramedulläre Myelom. Hauptmanifestationsalter ist die 6.-7. Lebensdekade. Klinisch bestehen neben einer Fatigue oft unspezifisch skelettale Beschwerden. Radiologisch imponiert eine osteolytische Knochendestruktion, scharf oder unscharf demarkiert, eine periostale Reaktion ist untypisch; Manifestation auch als (sekundäre) Osteoporose ohne Nachweis umschriebener Osteolysen. Die Prognose hat sich durch neue Medikamente und Fortschritte in der Stammzelltransplantation deutlich verbessert.
Synonyme
- MM (multiples Myelom)
- nicht empfohlen: Morbus Kahler
Keywords
- multiples Myelom, MM, Plasmazellmyelom, Morbus Kahler, Osteolyse, sekundäre Osteoporose, Immunglobulin, Leichtketten
Definition
- WHO [1]: Das Plasmozytom des Knochens bzw. multiple Myelom ist eine neoplastische, monoklonale Proliferation von Plasmazellen (Abb. 16.1).
- Das MM wird der Gruppe der reifen B-Zell-Neoplasien zugerechnet. Die Zellen bilden monoklonale Immunglobuline (IgG 55%, IgA 25%, IgD/IgE/IgM 1%) oder Leichtketten (20%), asekretorische Myelome sind extrem selten.
- POEMS-Syndrom (Crow-Fukase-Syndrom): Kombination aus peripherer Polyneuropathie, Organomegalie (Leber, Milz), Endokrinopathie (Gynäkomastie, Hypothyreose), monoklonaler Gammopathie und Hautläsionen („skin changes“, wie Hyperpigmentierungen).
Epidemiologie
Häufigkeit
- insgesamt eher selten, das solitäre Plasmozytom des Knochens macht < 5% aller Plasmazellneoplasien aus
- die Inzidenz des multiplen Myeloms beträgt etwa 5–6/100.000/Jahr
- unter den hämatologischen Neoplasien ist MM nach der chronisch lymphatischen Leukämie (CLL) zweithäufigste maligne Erkrankung
Altersgipfel
- 6.-7. Lebensdekade, selten Diagnose vor dem 40. Lebensjahr (ca. 2%)
Geschlechtsverteilung
- Männer sind häufiger betroffen als Frauen (m:w = 3:2)
Prädisponierende Faktoren
- chronische Antigenexposition, Viren (KSHV, Kaposi Sarcoma-associated Herpesvirus)
- Chemikalien: Schwermetalle, organische Lösungsmittel, Benzol
- ionisierende Strahlen
Ätiologie und Pathogenese
- chromosomale Aberrationen in >50% der Fälle: Chromosomen 13 (del 13q14), 14 (Immunglobulinlokus, t(11;14), t(4;14), t(14;16)), 11 (bcl-1, cyclin D) oder 8 (c-myc)
- Hochrisikosituation (25% der Fälle): del 17p13, t(14;16), (t14;20), t(4;14), Aberrationen von Chromosom 1, Hypodiploidie
Klassifikation und Risikostratifizierung
- Lodwick-Grad: I–III
- Plasmozytom (solitärer Herd) vs. multiples Myelom (multizentrisch) vs. extramedulläres Plasmozytom/Myelom
- Staging nach ISS (International Staging System)
- CRAB-Kriterien (Kalzium, renale Insuffizienz, Anämie, „bone lesions“)
Symptomatik
- lokale, oft auch diffuse skelettale Schmerzen
- Beschwerden können belastungsabhängig auftreten, in Ruhe, an wechselnden skelettalen Lokalisationen
- häufig pathologische Frakturen, insbesondere im Bereich Wirbelsäule
Methode der Wahl
- CT (low-dose, Ganzkörper) zur Erfassung des Ausmaßes der Skelettschädigung beim symptomatischen Myelom
- MRT (Ganzkörper) oder PET/CT kann zur Beurteilung des Knochenmarksbefalls und möglicher extramedullärer Herde durchgeführt werden.
- bei Patienten mit (solitärem) skelettalem Plasmozytom erweiterte Bildgebung mittels Ganzkörper-CT, Ganzkörper-MRT oder PET/CT, um mögliche weitere Manifestationen eines MM ggf. zu identifizieren
- typische Laborbefunde und Histologie
Pathognomonische Befunde
- Typisch, nicht pathognomonisch, sind beim multiplen Myelom meist multiple, initial wie ausgestanzt imponierende, teils auch konfluierende Osteolysen unterschiedlicher Größe, beim Plasmozytom der singuläre Herd.
Befundbeschreibung
Lokalisation
- meist Wirbelsäule, gefolgt von Femur, Schädel, Becken, Sternum, Rippen und Humerus, oft multifokaler Befall
- nur in seltenen Fällen Manifestation im Bereich kurzer Röhrenknochen
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
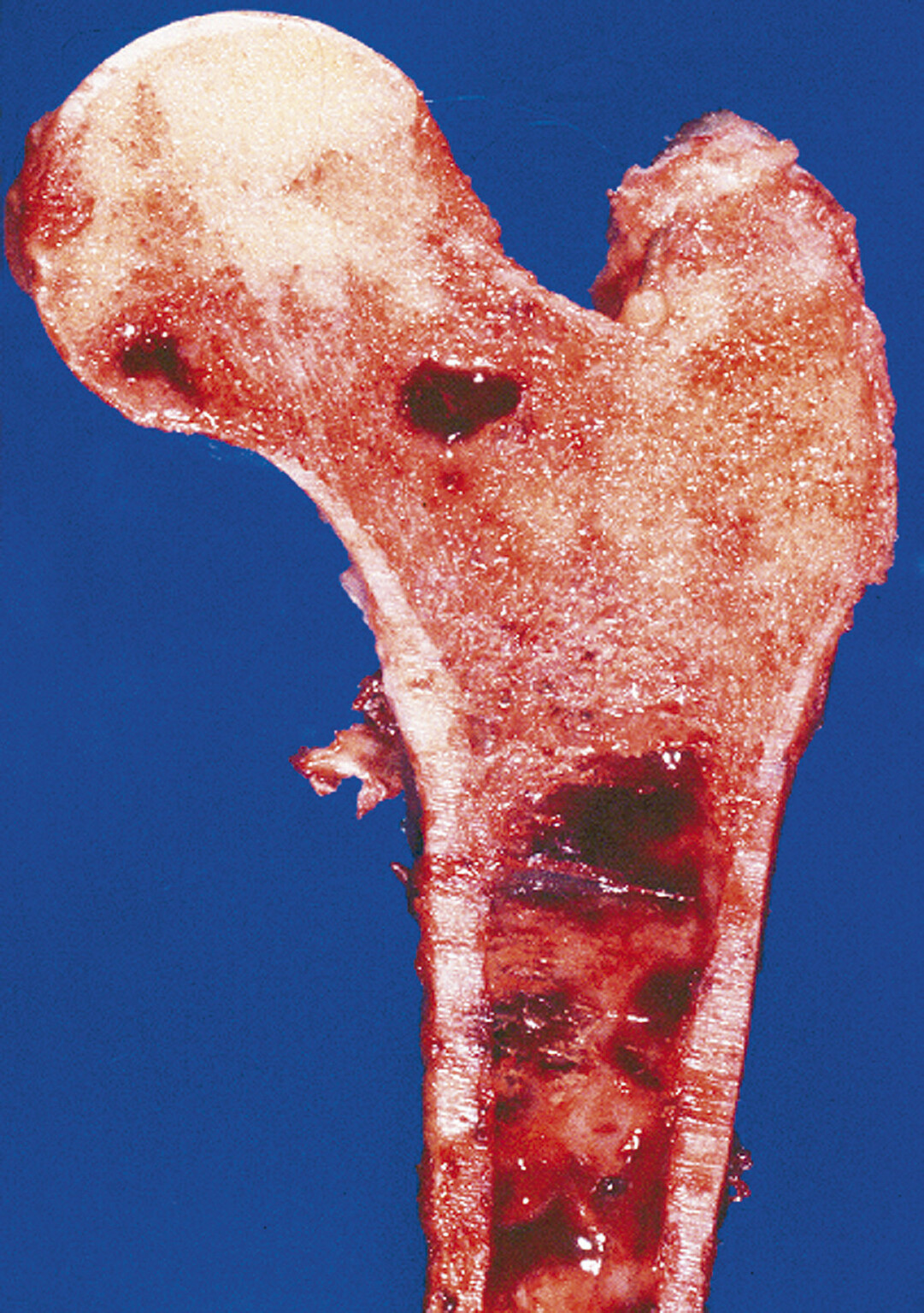
Abb. 16.1 Makroskopisches Präparat des proximalen Femurs mit Nachweis mehrerer Herde eines Myeloms.
Das Tumorgewebe imponiert rötlich und ersetzt das normale Knochenmark. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
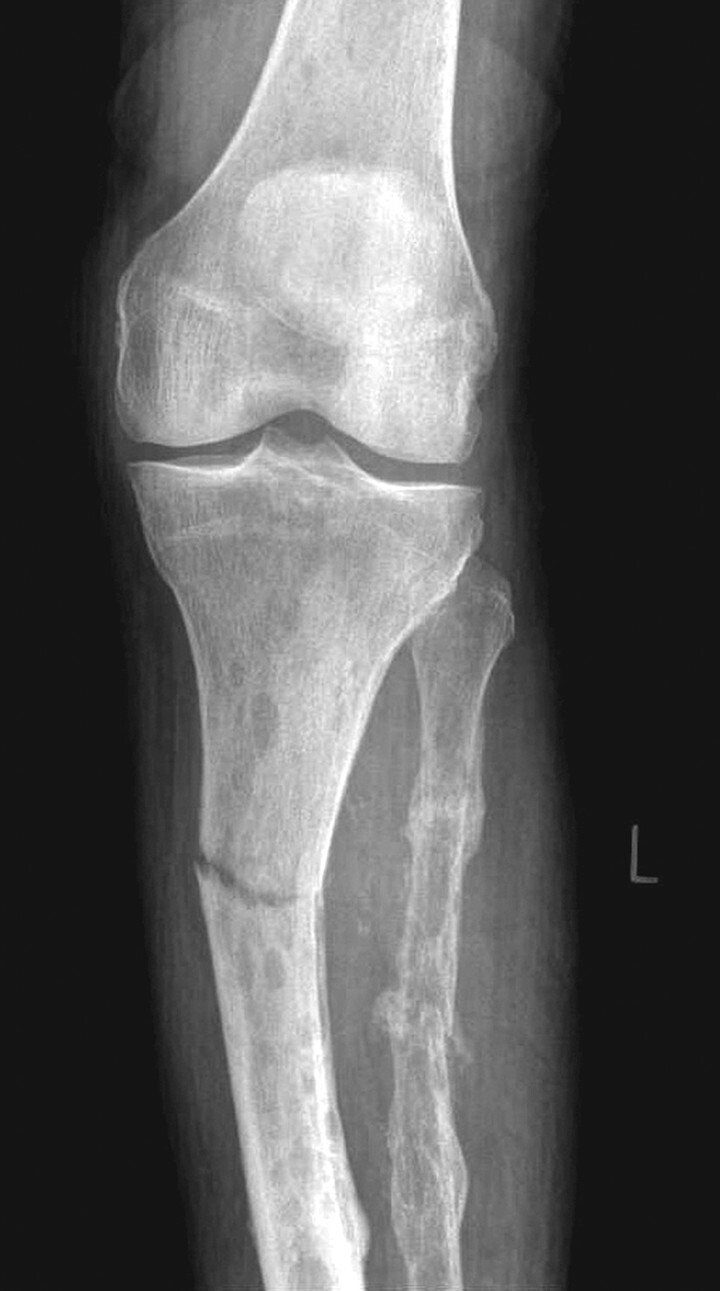
Abb. 16.2 Multiples Myelom bei einem älteren Patienten.
Durchsetzung von Tibia und Fibula durch multiple Osteolysen mit Frakturen unterschiedlichen Alters. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Abb. 16.3 Beispiele von MM Osteolysen im Bereich des Wirbelkörpers.
a Typus der diffusen feinfleckigen Osteolysen, die schließlich zu großen Osteolysen konfluieren. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
b Typus der „großen Osteolyse“, mit Auslöschung der Knochentrabekel, während die Kortikalis des Wirbelkörpers länger stehen bleibt. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
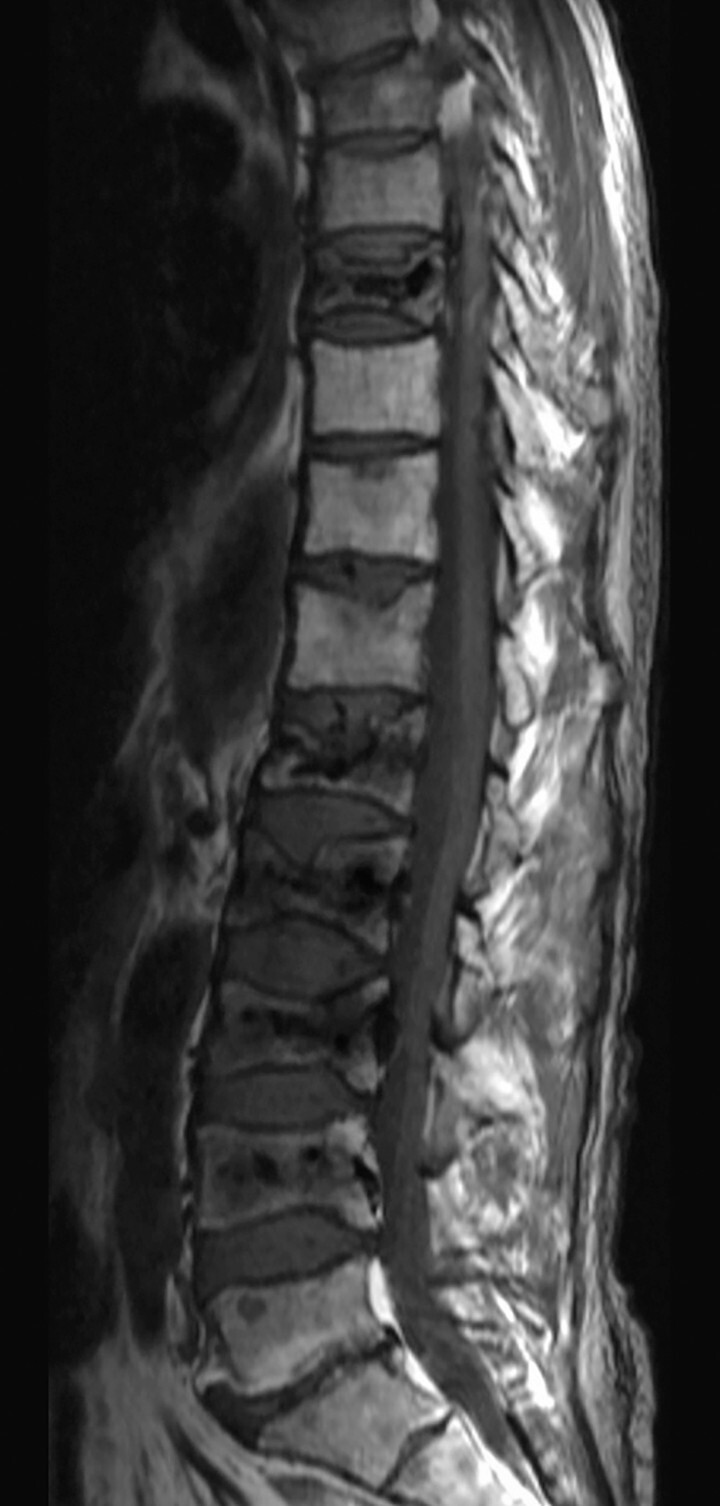
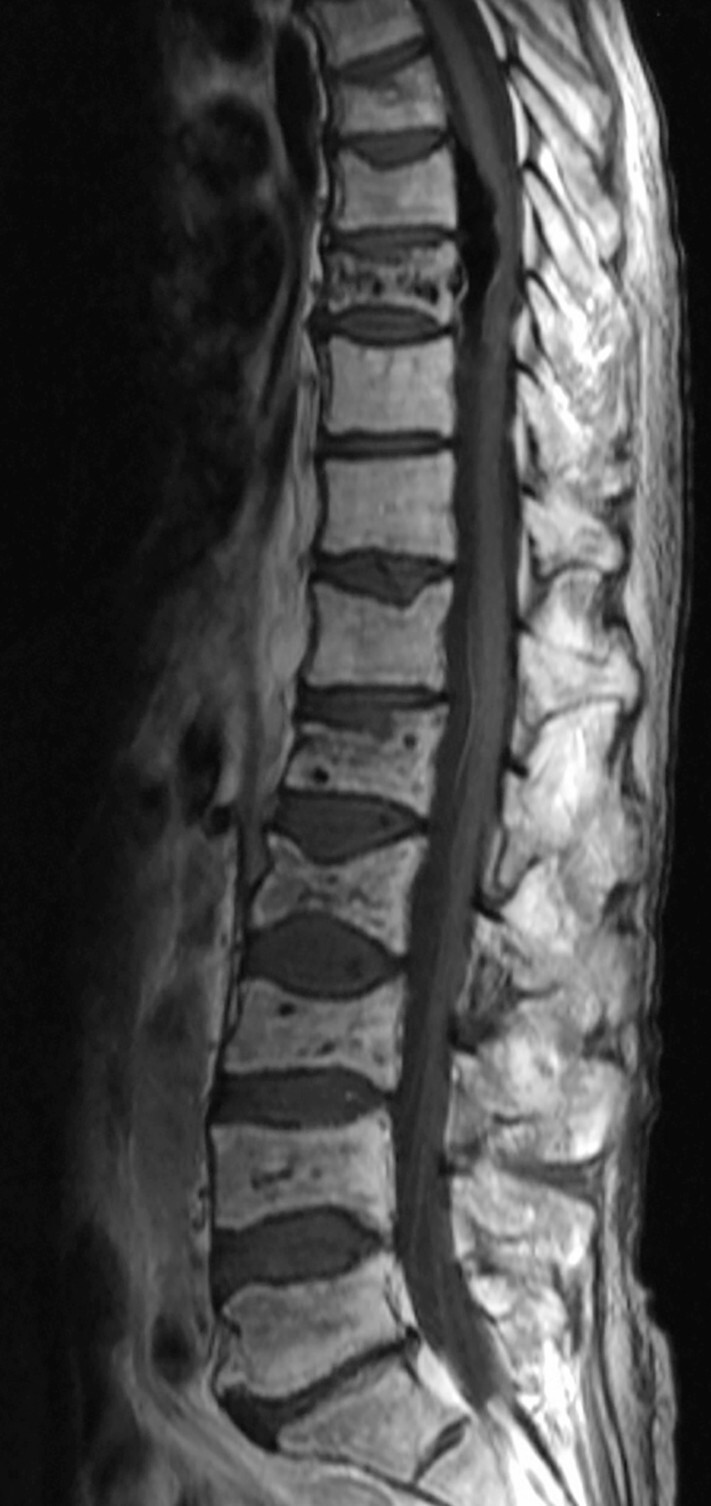
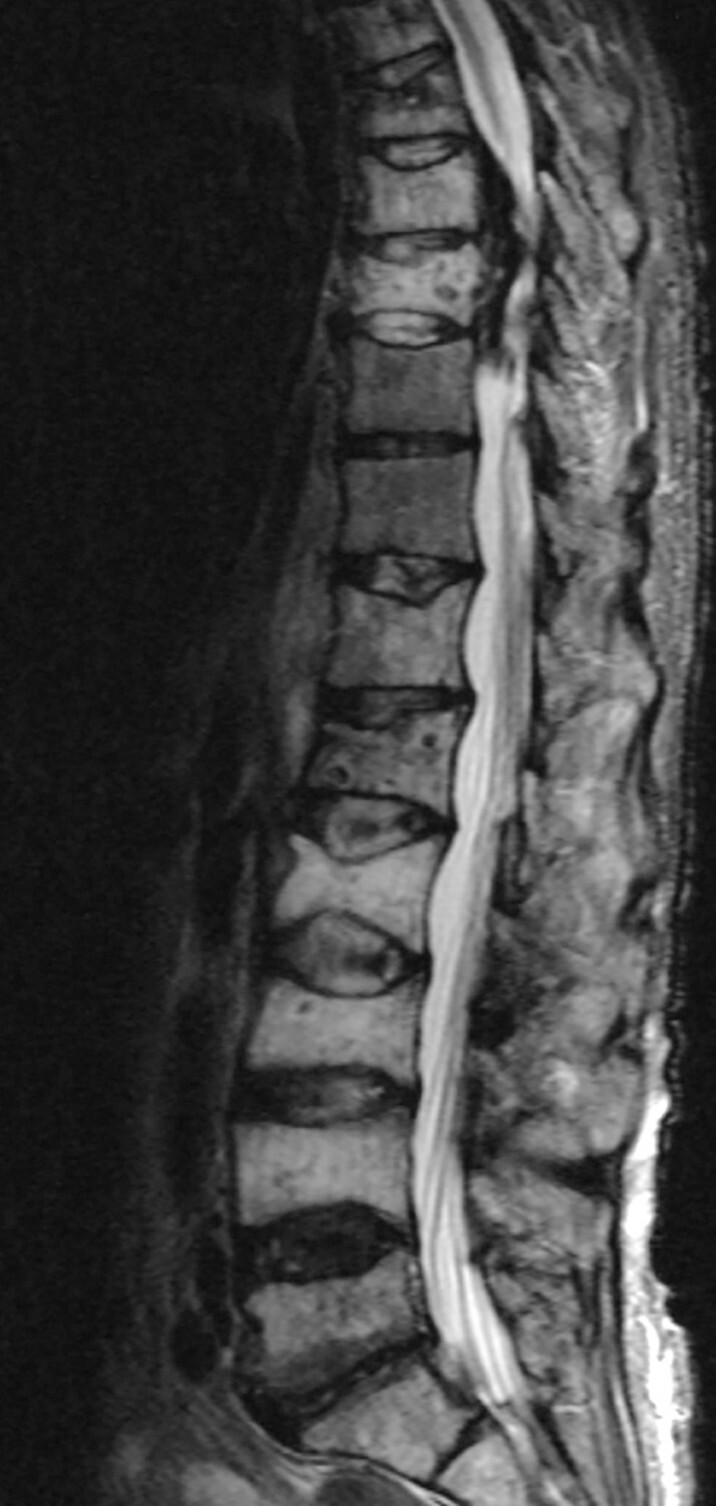
Abb. 16.4 Multiples Myelom mit Manifestation im Bereich der LWS.
Der Tumor hat zu zahlreichen pathologischen Wirbelkörperfrakturen geführt.
a MRT T1; die befallenen Wirbelkörper sind hypointens im Vergleich zu den nicht befallenen Wirbelkörpern und hypointens im Vergleich zu Bandscheiben. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
b MRT T1 fettsupprimiert nach Kontrastmittelgabe. Die betroffenen Wirbelkörper reichern mäßiggradig Gadolinium-DTPA an. Die befallenen Wirbelkörper sind nun isointens zu den nicht befallenen Wirbelkörpern. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
c Befallene Wirbelkörper sind geringfügig hyperintenser als die nicht befallenen Wirbel in der fettsupprimierten MRT T2. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
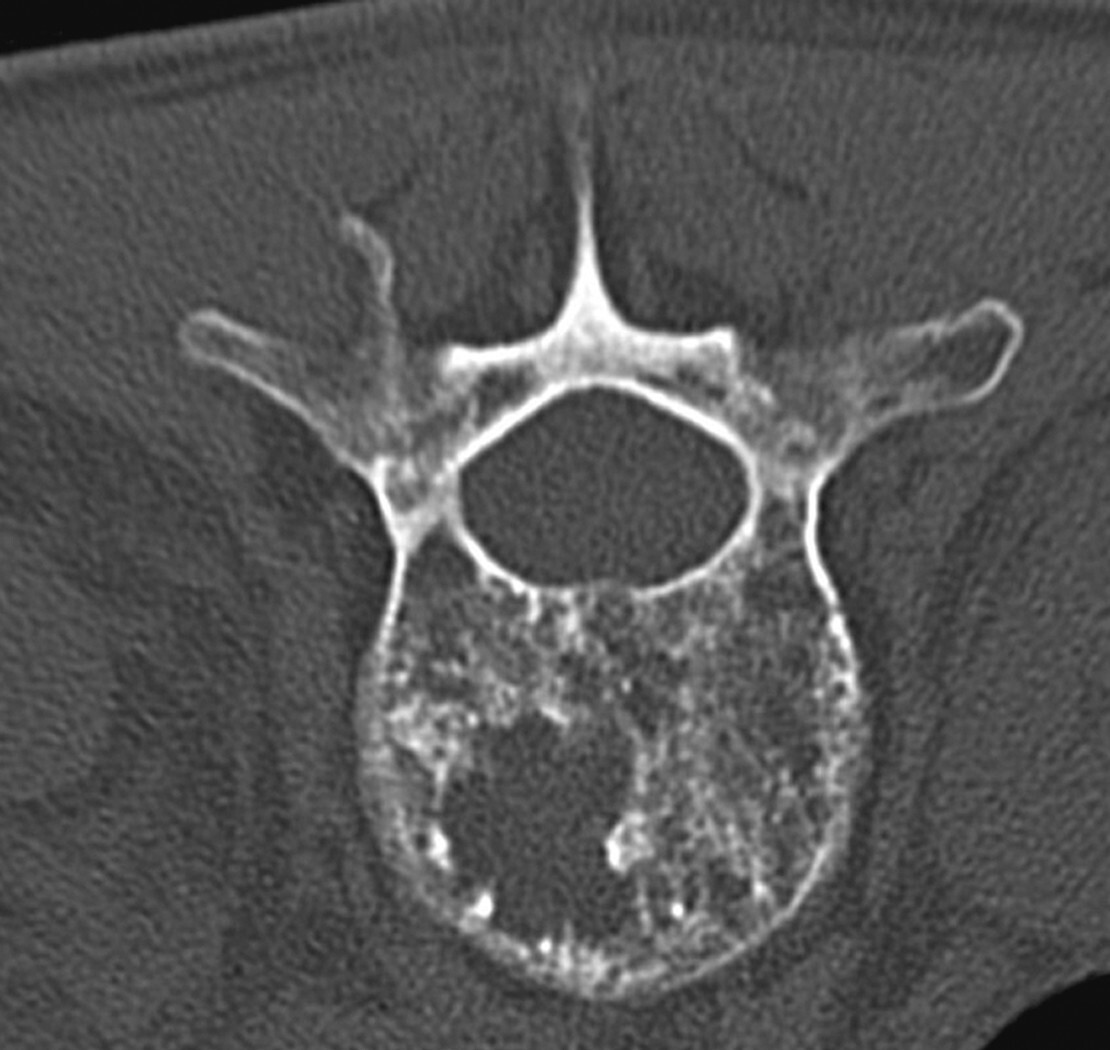
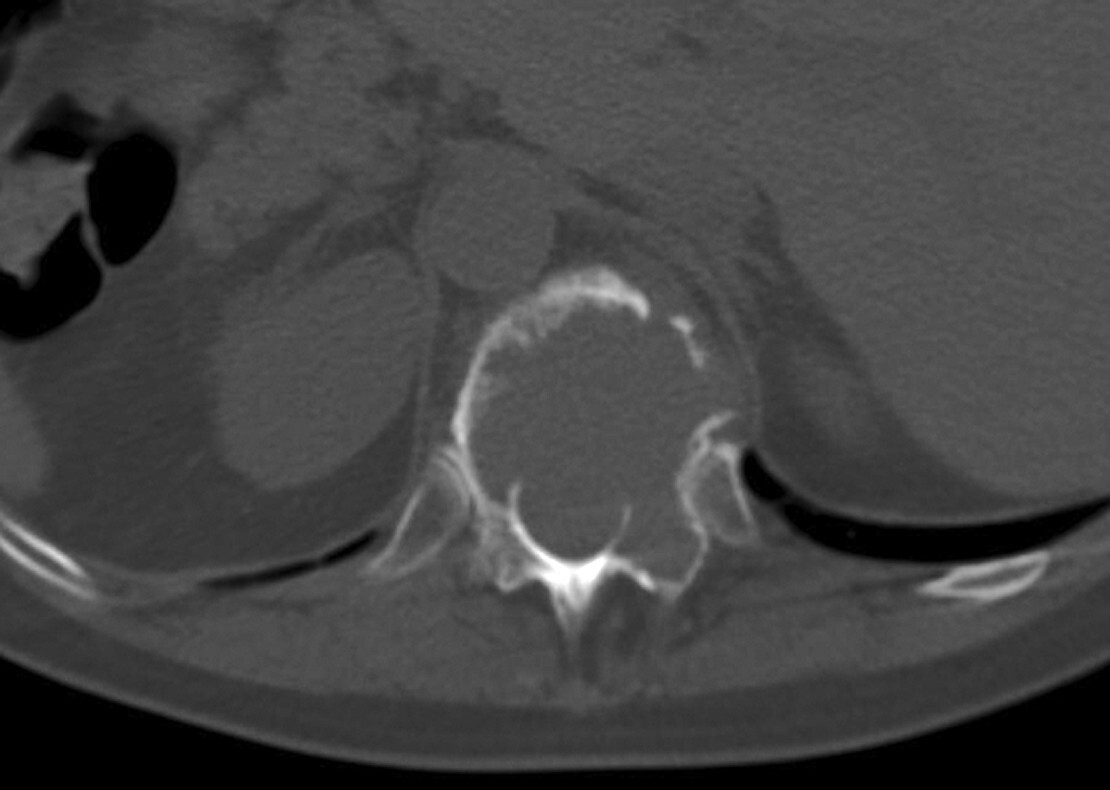
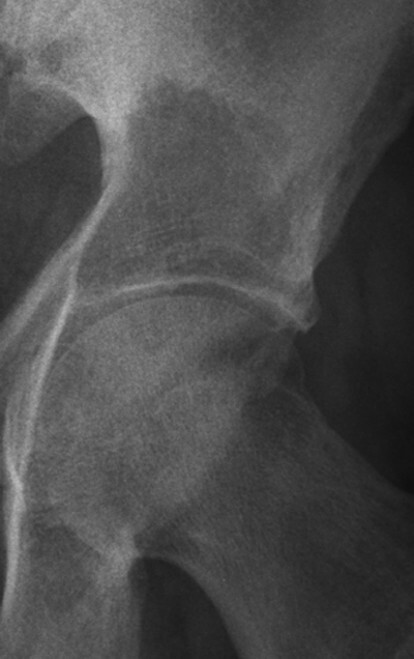
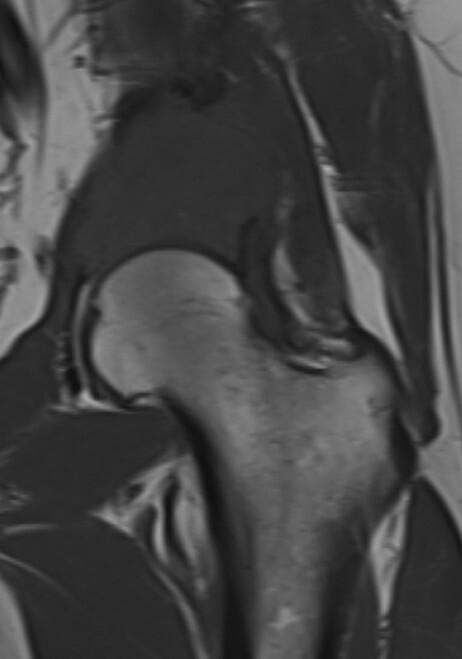
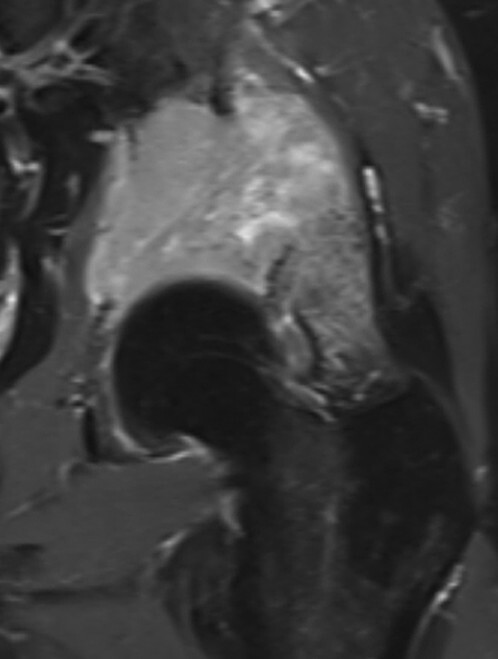
Abb. 16.5 Supraazetabuläre Osteolyse bei Multiplem Myelom.
a Ausgedehnte Osteolyse ohne randsklerotische Begrenzung in der Nativradiologie.
b In der MRT T1 stellt sich der MM-Herd iso- bis leicht hyerintens dar.
c In der MRT T1 TSE fettsupprimiert Nachweis einer deutlichen KM-Aufnahme.
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
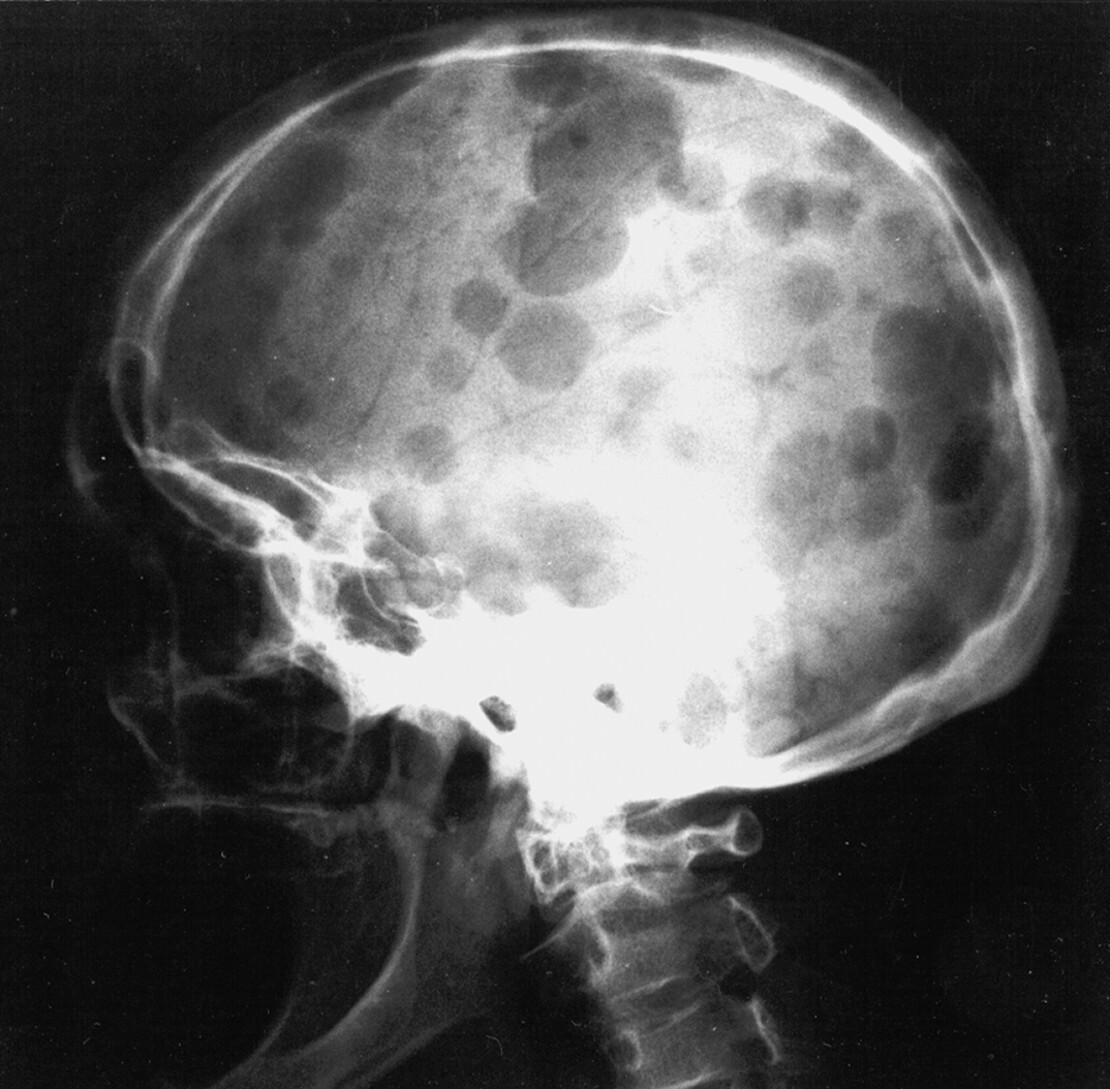
Abb. 16.6 Osteolysen der Schädelkalotte bei multiplem Myelom.
Der „Schrotschussschädel“ ist ein klassisches Röntgenzeichen. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
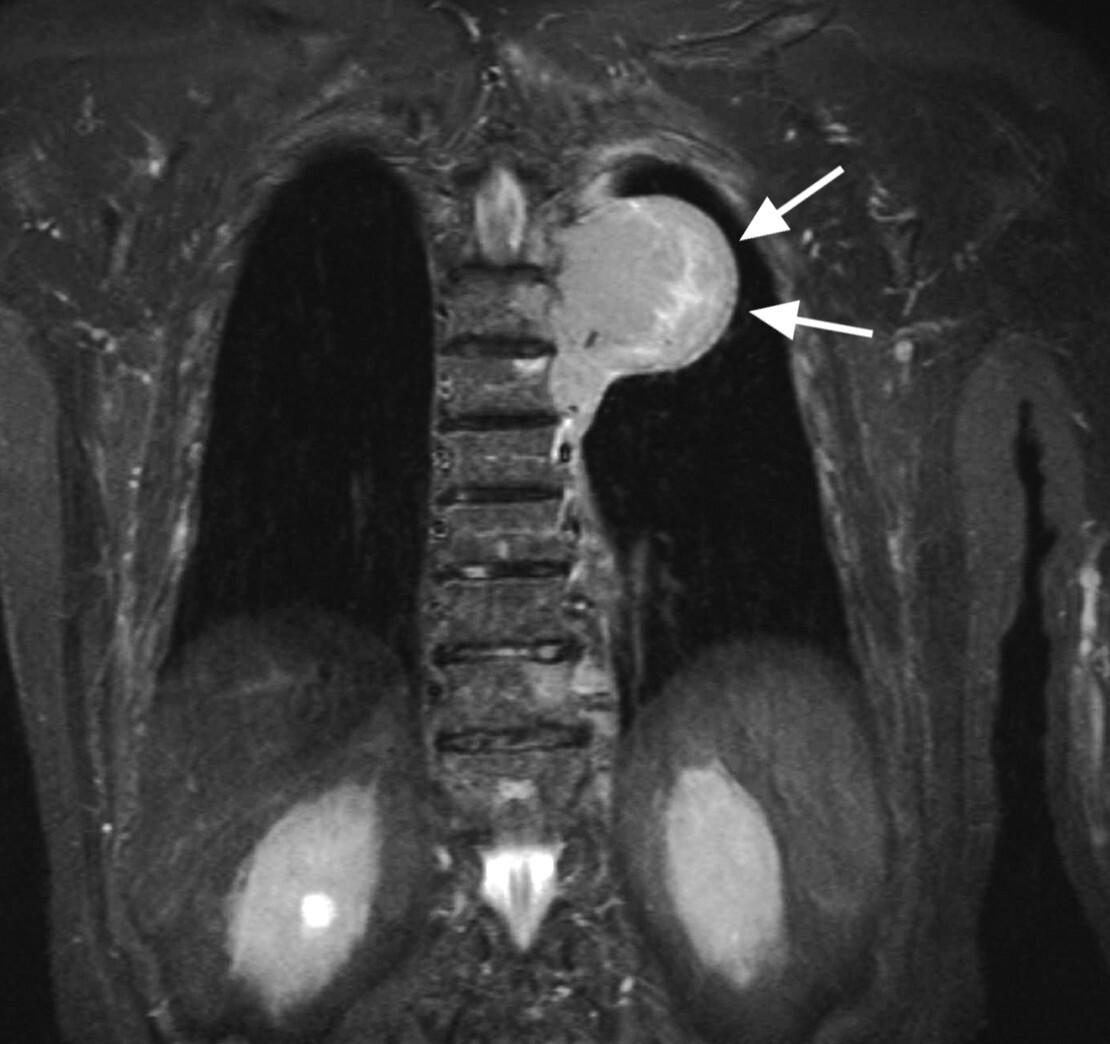
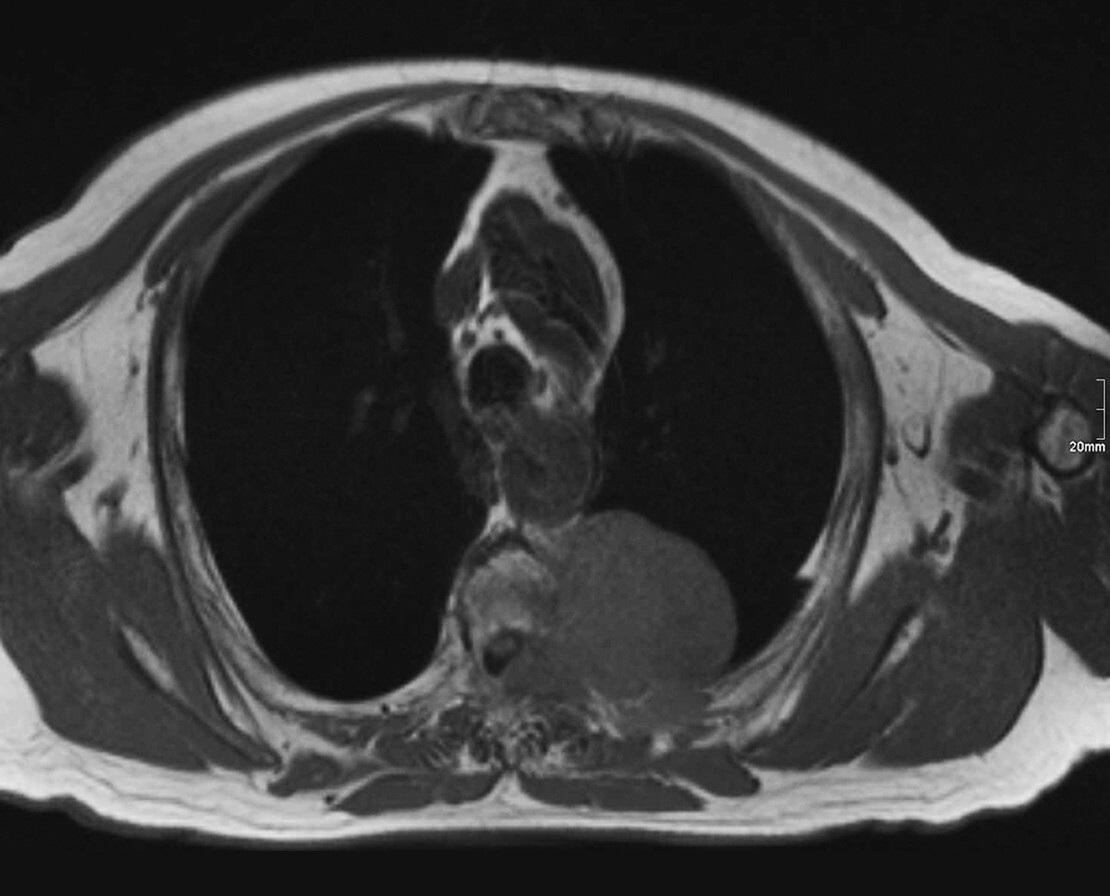
Abb. 16.7 Extraspinales Plasmozytom.
a Nachweis einer großen Weichteilmasse neben der Brustwirbelsäule in der MRT TIRM-Sequenz T2. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
b In der T1 homogene paraspinale Weichteilmasse, geringer hyperintens zur Muskulatur. Der Wirbelkörper wurde sekundär infiltriert. (Quelle: Uhl M, Herget G, Rottenburger C. Osteomyelogene Knochentumoren. In: Uhl M, Herget G, Hrsg. Radiologische Diagnostik von Knochentumoren. 2., überarbeitete Auflage. Stuttgart: Thieme; 2015)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
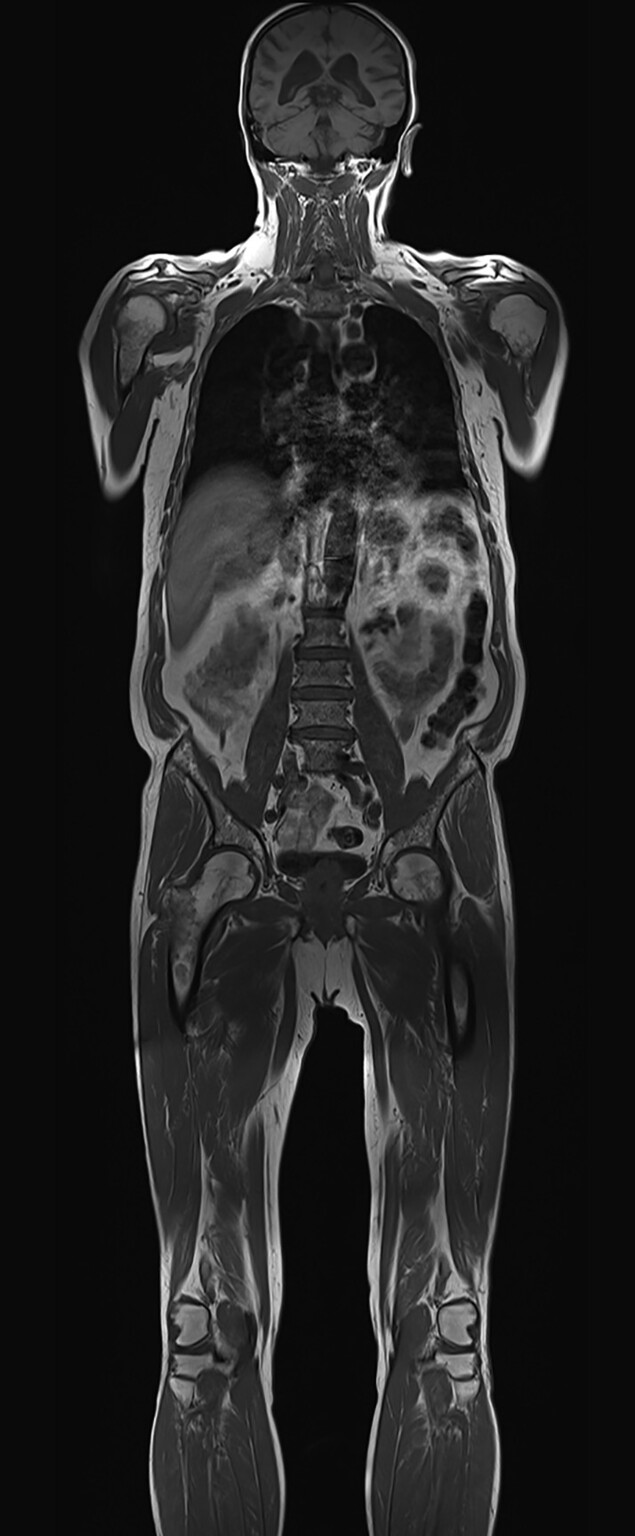
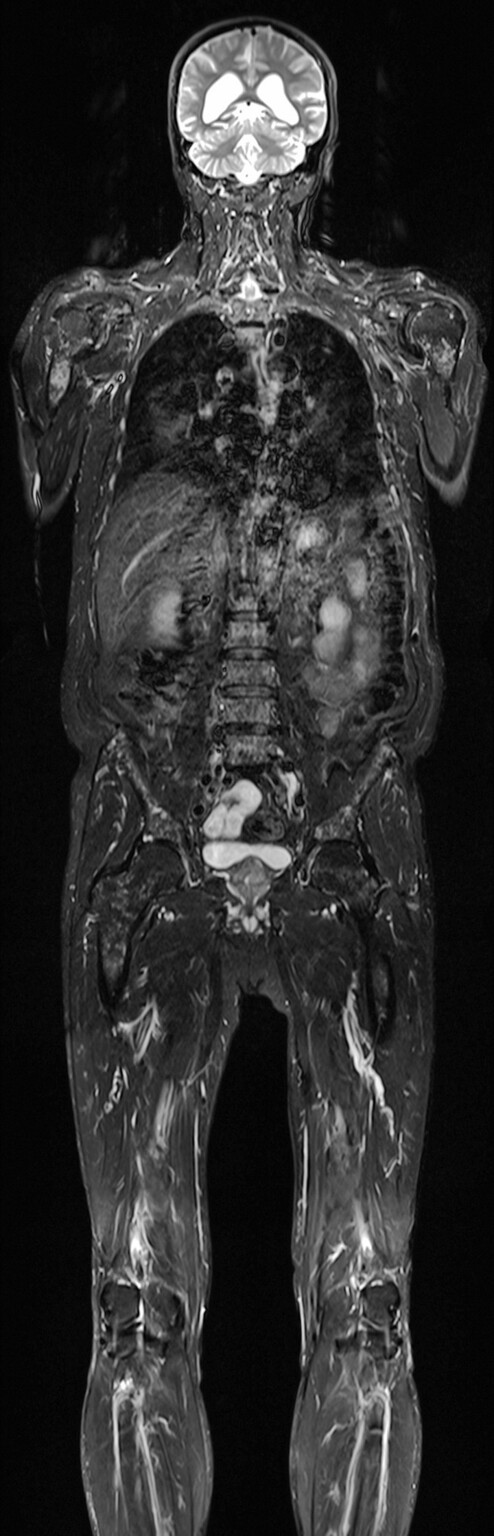
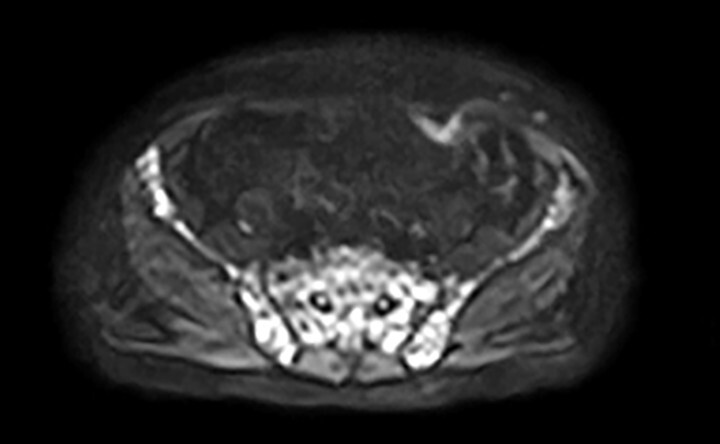
Abb. 16.8 Multiples Myelom in der vergleichenden MRT-Darstellung.
Das inhomogene Knochenmark mit fleckförmiger Verdrängung des Fettmarks kann gut in den Femora und im Beckenskelett gesehen werden. Die DWI visualisiert sehr kontrastreich die dunklen Myelomherde durch die eingeschränkte Diffusion in den hyperzellulären Herden.
a MRT T1. (Quelle: Prof. Dr. S. Delorme, DKFZ Heidelberg)
b Darstellung mit fettsupprimierter T2-Ganzkörper-MRT. (Quelle: Prof. Dr. S. Delorme, DKFZ Heidelberg)
c Diffusionswichtung (DWI) (b=800). (Quelle: Prof. Dr. S. Delorme, DKFZ Heidelberg)
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
 Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
Quelle: Quelle: Uhl M, Herget G, Baumhoer D, Ruf J. Plasmozytom des Knochens/Multiples Myelom. In: Uhl M, Herget G, Baumhoer D, Ruf J, Hrsg. Referenz Radiologie – Knochentumoren. 1. Auflage. Stuttgart: Thieme; 2022. doi:10.1055/b000000484
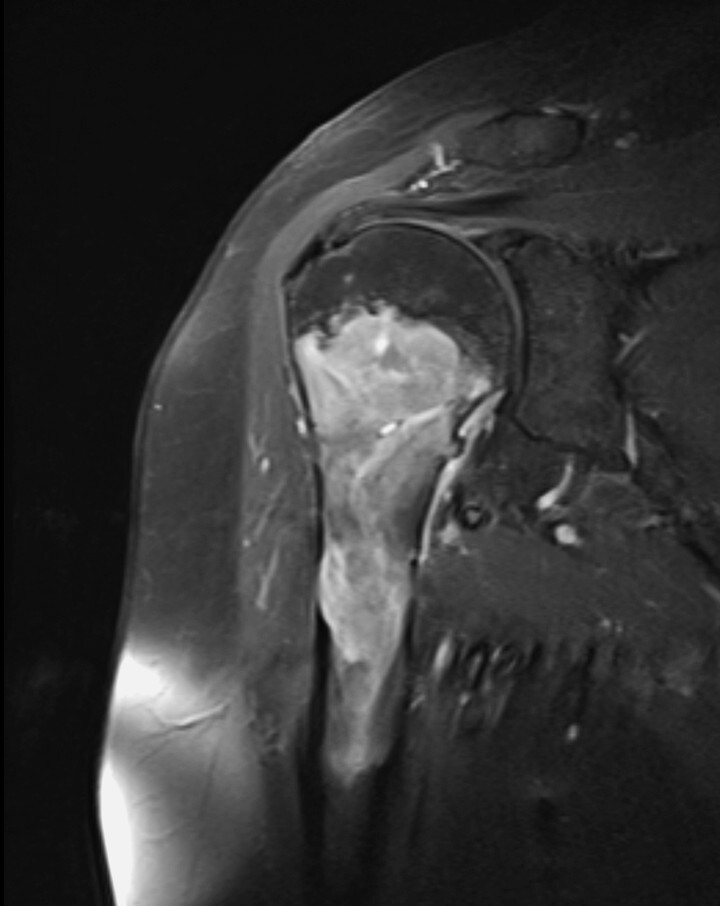
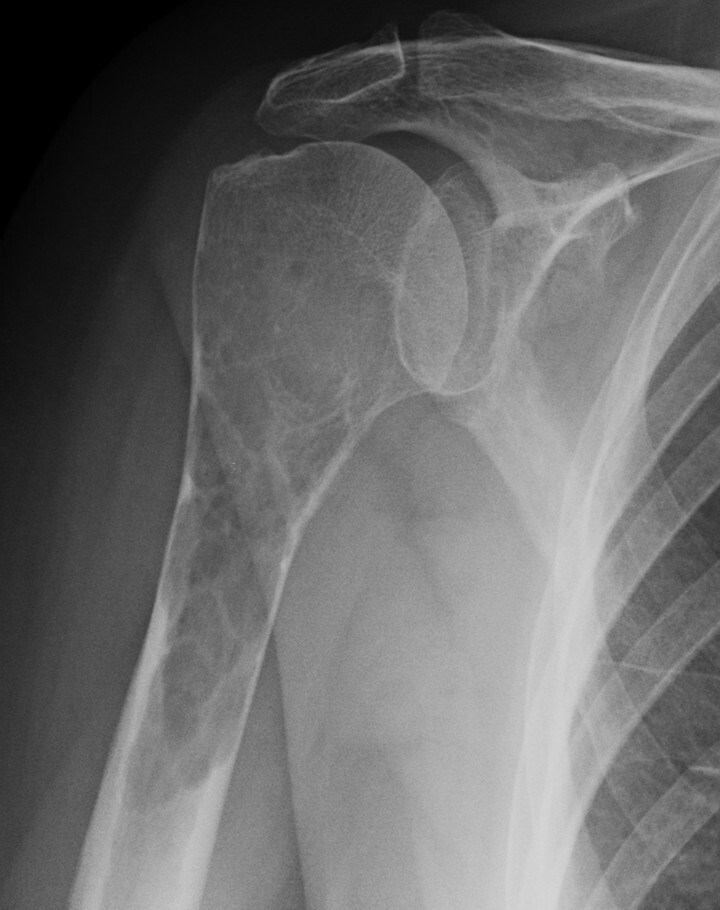
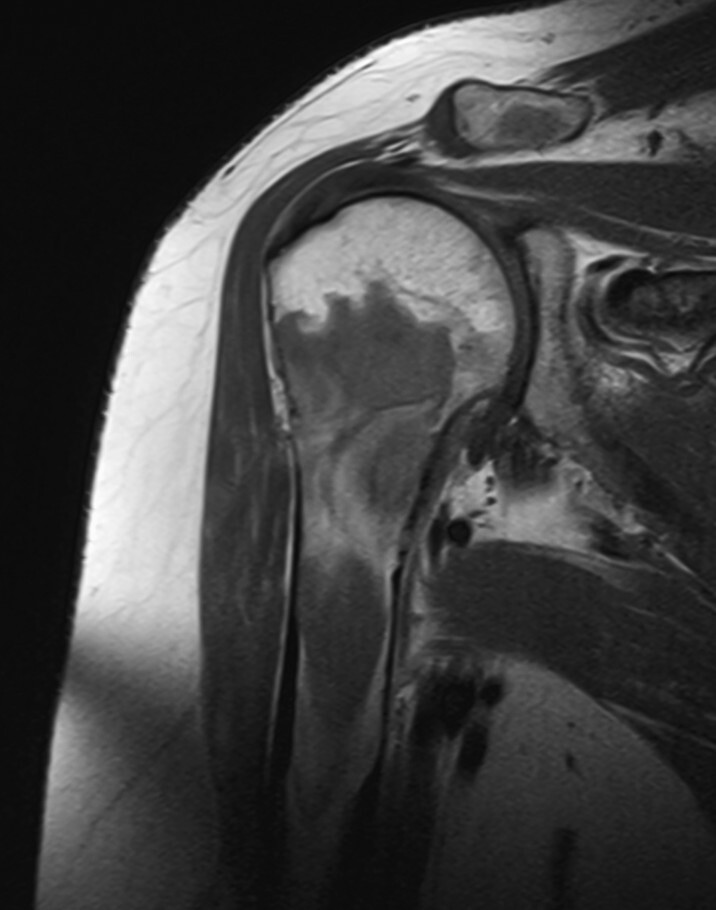
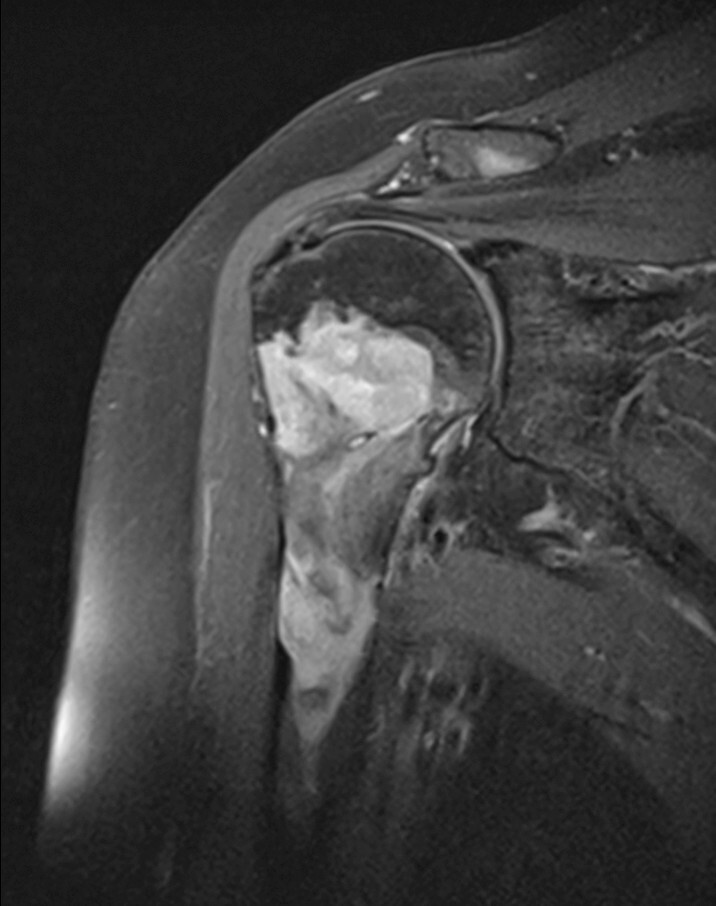
Abb. 16.9 Myelomherd der Humerusmetadiaphyse.
a Nativradiologisch Nachweis einer Osteolyse mit hochgradiger Ausdünnung der Kortikalis.
b Die MRT SE T1 zeigt diesen Herd inhomogen, die hypointensen Anteile sind gering hyperintenser als Muskulatur.
c Die fettsupprimierte MRT T2 zeigt die inhomogene Tumormasse.
d Nach KM-Gabe werden die nekrotischen Myelomanteile im MRT als hypointense Areale demarkiert.
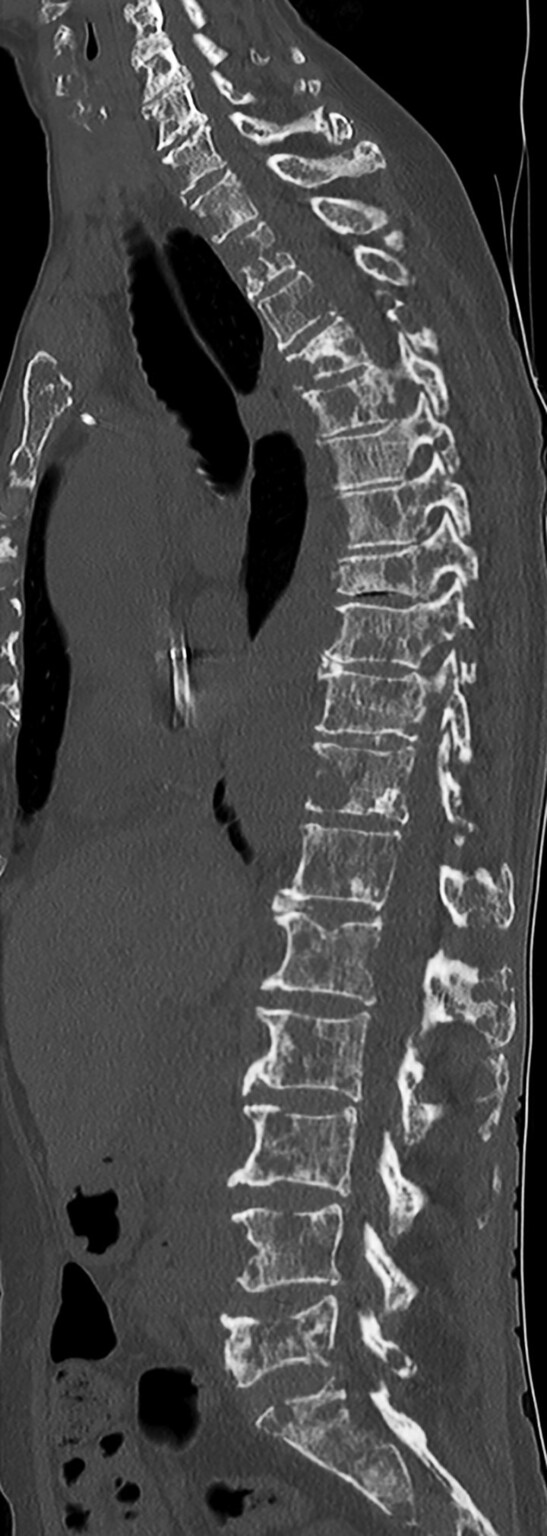
Abb. 16.10 Multiples Myelom mit diffuser osteolytischer Durchsetzung des Achsenskeletts.
Röntgen
Abb. 16.2, Abb. 16.5a, Abb. 16.6, Abb. 16.9
- osteolytische Knochendestruktionen, scharf oder unscharf demarkiert, von unterschiedlicher Größe, gelegentlich von expansivem Charakter
- „Schrottschussschädel“ bzw. „raindrop skull“: multiple osteolytische Herde des Schädelknochens
- Kortikalis kann mottenfraßartig arrodiert sein
- periostale Reaktion und Knochenneubildung sind untypisch
- Wirbelsäule: Wirbelbögen und Wirbelfortsätze werden erst im Spätstadium destruiert
- Röhrenknochen: kortikales Scalloping kann hinweisend auf Markbefall sein
- Manifestation als (sekundäre) Osteoporose ohne Nachweis umschriebener Osteolysen möglich
CT
Abb. 16.3, Abb. 16.10
- osteolytischer Herd innerhalb des Knochen-/Fettmarks mit muskelisointensen Dichtewerten
- umschriebener, muskelisointenser Herd mit Destruktion der Spongiosa ohne Randsklerose
- Nachweis eines möglichen Markbefalls großer Röhrenknochen
- Stabilitätsbeurteilung
MRT
Abb. 16.4, Abb. 16.5b und Abb. 16.5c, Abb. 16.7, Abb. 16.8, Abb. 16.9b–Abb. 16.9d
- Myelomherde in T1 hypointens, in T2-Sequenzen heterogenes, regelhaft hyperintenses Signal
- nach KM-Gabe diffuse moderate (selten ringförmige) Anreicherung
- STIR-/TIRM-Sequenzen: deutlich hyperintense Abbildung der Myelomherde
- diffusionsgewichtete Sequenzen: eingeschränkte Diffusion im MM-Herd
- Weichteilmasse möglich, im Spinalbereich oft epidural oder paravertebral
- Es werden 5 MRT-Muster des Knochenmarkbefalls unterschieden:
- normales Mark
- diffuser Markbefall
- fokale Markläsionen
- kombinierte diffuse und fokale Läsionen
- „Pfeffer-Salz-Muster“
Szintigrafie
- weist in aller Regel keine erhöhte Tracerspeicherung auf, nicht indiziert
PET/CT
- erhöhte FDG-Aufnahme in ossären/medullären und extraossären Herden
- bei inkonklusiver MRT Einsatz der Methode FDG-PET zum Läsionsausschluss bei V.a. monoklonale Gammopathie unklarer Signifikanz (MGUS), bei V.a. „smoldering multiple myeloma“ (SMM) oder zur Bestätigung eines (solitären) Plasmozytoms
- bei stabiler MGUS und stabil-asymptomatischem MM ist die FDG-PET unauffällig oder zeigt eine allenfalls diskrete, diffuse Knochenmarksspeicherung
- mögliche Beurteilung eines Therapieansprechens und damit der Prognose
Radiologische Differenzialdiagnose
| Tab. 16.1 Radiologische Differenzialdiagnosen des Plasmozytoms/Multiplen Myeloms. |
| Differenzialdiagnose (absteigend sortiert nach klinischer Relevanz*) | Häufigkeit der Differenzialdiagnose in Hinblick auf das Krankheitsbild (häufig, gelegentlich, selten) | Wesentliche diagnostisch richtungsweisende Anamnese, Untersuchung u./o. Befunde | Sicherung der Diagnose |
| Knochenmetastase | häufig |
|
Biopsie |
| eosinophiles Granulom/Langerhans-Zell-Histiozytose | seltener |
|
Biopsie |
| osteoporotische Fraktur | häufig |
|
CT, ggf. MRT |
| *Klinische Relevanz ist nicht immer gleichbedeutend mit Häufigkeit. Auch seltene Differenzialdiagnosen können klinisch sehr relevant sein. |
Typische Fehler
- Verwechslung mit osteolytischen Knochenmetastasen
- Nichterkennen einer malignen Grunderkrankung bei Diagnose „Osteoporose“
Was der*die zuweisende Kolleg*in/Kliniker*in wissen muss
- Ganzkörper-CT in low-dose-Technik als Standardverfahren
- MRT zur Detektion von Weichteilherden, zur Abklärung unklarer Osteolysen und einer sekundären Osteoporose insgesamt deutlich sensitiver als CT
- Besonders bewährt ist die koronare Ganzkörper-T1-Bildgebung und diffusionsgewichtete Sequenzen, am besten mit multiplanaren Projektionen (MIP). Die diffuse oder fokale Plasmazellinfiltration des Knochenmarks wird über die Kombination aus einem Signalabfall in der T1 und Signalanstieg in der fettsupprimierten T2 erbracht.
- Dixon-Technik mit „nur Fett-Auslese“ (fat-only) besonders sensitive Sequenztechnik zur Darstellung von MM-Herden
- als Therapieansprechen kann im CT die Dichteabnahme innerhalb der Osteolyse und/oder die Ausbildung einer Randsklerose gewertet werden
- Im MRT kann die Normalisierung des T1 bzw. T2 Signals und/oder die Ausbildung eines hypointensen Randsaumes als Therapieansprechen gewertet werden.
Prognose
- Monoklonale Gammopathien manifestieren sich in 3 Stadien: der monoklonalen Gammopathie unklarer Signifikanz (MGUS), dem schwelenden Myelom („smoldering multiple myeloma“ (SMM), Zwischenstadium) und dem multiplen Myelom (MM).
- Etwa 3–4% der über 50-Jährigen haben MGUS; Risiko, dass MGUS in MM übergeht, kann anhand bestimmter Risikofaktoren (monoklonales Protein ≥15g/l, Quotient der freien Kappa- und Lambda-Leichtketten im Serum, Typ M-Protein) eingeschätzt werden.
- Die Prognose kann mit verschiedenen Gensignaturen abgeschätzt werden.
- Werden in der FDG-PET oder im Ganzkörper-MRT mehr als 25 Knochenmarkläsionen gefunden, ist die Prognose meist schlecht.
- Die mittlere Überlebenszeit beträgt 5–8 Jahre; durch neue Medikamente und Fortschritte in der Stammzelltransplantation hat sich die Prognose deutlich verbessert, Überlebenszeiten >10 Jahre werden von etwa 30% der Patienten erreicht.
Quellenangaben
- [1] Ferry JA, Deshpande V, Lorsbach RB. Solitary plasmacytoma of bone. In: International Agency for research on Cancer. WHO Classification of Tumors, Soft Tissue and Bone Tumors. 5. Aufl. Lyon: IARC; 2020: 483–484
Suche in: PubMed Google Scholar
Literatur zur weiteren Vertiefung
- [1] Caers J, Garderet L, Kortüm KM et al. European Myeloma Network recommendations on tools for the diagnosis and monitoring of multiple myeloma: what to use and when. Haematologica 2018; 103(11): 1772–1784
Suche in: PubMed Google Scholar - [2] Cavo M, Terpos E, Nanni C et al. Role of (18)F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group. Lancet Oncol 2017; 18(4): 206–217
Suche in: PubMed Google Scholar - [3] Engelhardt M, Waldschmidt J, Wäsch R. Multiples Myelom. In: Berger DP, Mertelsmann R, Hrsg. Das Rote Buch: Hämatologie und Internistische Onkologie. 6. Aufl. Landsberg a.L.: ecomed; 2017:8 29–837
Suche in: PubMed Google Scholar - [4] Herget GW, Wäsch R, Klein L et al. Prevention of bone disease and early detection of impending fractures in multiple myeloma patients can reduce morbidity and mortality: the necessity of interdisciplinary state-of-the-art treatment. Haematologica 2020; 105(4): 859–861
Suche in: PubMed Google Scholar - [5] Herget GW, Kälberer F, Ihorst G et al. Interdisciplinary approach to multiple myeloma – time to diagnosis and warning signs. Leuk Lymphoma 2021; 62(4): 891–898
Suche in: PubMed Google Scholar - [6] Filho A, Carneiro BC, Pastore D et al. Whole-body Imaging of Multiple Myeloma: Diagnostic Criteria. Radiographics 2019: 39; 1077–1097
Suche in: PubMed Google Scholar - [7] Köhler M, Greil C, Hudecek M et al. Current developments in immunotherapy in the treatment of multiple myeloma. Cancer 2018; 124(10): 2075–2085
Suche in: PubMed Google Scholar
Herausgeber*innen, Autor*innen
Autoren: Markus Uhl, Georg W. Herget, Daniel Baumhoer, Juri Ruf
Letzte Änderung: 06.07.2022